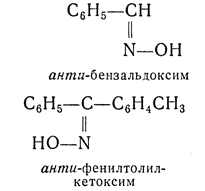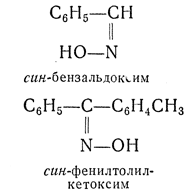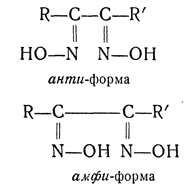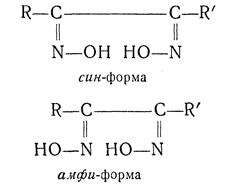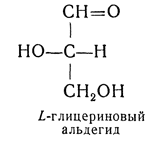Некоторые важнейшие приставки (префиксы) и окончания (суффиксы)
-аза — окончание в названиях энзимов или ферментов (мальтаза, амилаза, лактаза); присоединяется к названию (или корню названия) вещества, на которое действует энзим.
алло- — приставка, обозначающая, что данное соединение по химическому строению сходно с другим. Например, кофеин и аллокофеин. В случаях геометрической изомерии соединений с двойной связью обозначает более стабильную форму, в которую соединение превращается при нагревании: фумаровую кислоту можно назвать алломалеиновой, так как она является более стабильным изомером, образующимся при нагревании малеиновой кислоты.
-ал — окончание названий альдегидов по Женевской и Льежской номенклатурам.
амфи- — приставка, обозначающая положения 2,6 для двузамещенных нафталина. Применяется также для наименования некоторых стереоизомеров диоксимов (см. анти-).
-ан — окончание названий предельных (парафиновых) углеводородов.
ана- — приставка для обозначения 1,5-двузамещенных нафталина.
анти- — приставка, применяемая для обозначения стереоизомеров. Например, антивинная (мезовинная) кислота. Часто также применяется для обозначения стереоизомерных оксимов и гидразонов и указывает на диагональное расположение групп по отношению к плоскости двойной связи; в противоположность этому приставкой син- в ряду оксимов и гидразонов обозначают одностороннее расположение групп:
В ряду диоксимов кроме анти- и син-форм возможны еще амфи-формы:
(ср. также транс- и цис-).
аци- — приставка, обозначающая кислотную таутомерную форму нитросоединений.
би- — приставка, обозначающая удвоение радикала, например: бифенил.
бис-, трис-, тетракис- — приставки, указывающие на наличие двух, трех, четырех и т. д. сложных радикалов, например: бис-(диметиламино)-этан.
виц- — сокращение от вицинальный (соседний, рядовой).
втор- — сокращение от вторичный.
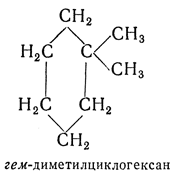
гем- — приставка, обозначающая (для полиметиленовых, динитро- и др. соединений) замещение двух атомов водорода у одного и того же атома углерода. Например:
гомо- — наиболее часто — приставка для обозначения гомологов, которые отличаются на одну группу СН2. Например, салициловая кислота С6Н4(ОН)СООН и гомосалициловая кислота С6Н4(ОН)СН2СООН, цистеин CH2(SH)CH(NH2)COOH и гомоцистеин CH2(SH)CH2CH(NH2)COOH.
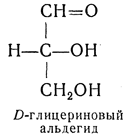
D — обозначение (от слова dexter — правый), указывающее на принадлежность одного из пары зеркальных изомеров (энантиомеров) к ряду соединений с определенной пространственной конфигурацией (D-ряд, или ряд D-глицеринового альдегида). Зеркальные изомеры с противоположной пространственной конфигурацией обозначают символом L (от слова laevus— левый), что также указывает на принадлежность их к стерическому ряду (L-ряд, или ряд L-глицеринового альдегида). Проекционные формулы зеркально-изомерных глицериновых альдегидов:
d — сокращение от слова dexter (правый); первоначально применялось для обозначения оптически активных соединений, вызывающих правое вращение плоскости поляризации света; оптические антиподы, вызывающие левое вращение, обозначали символом l — сокращение от слова laevus (левый). Затем символы d и l стали применять для обозначения принадлежности зеркальных изомеров по их пространственным конфигурациям к определенным стерическим рядам, и в этом значении они встречаются в литературе, наряду с символами D и L (d-ряд или D-ряд; l-ряд или L-ряд, см. выше). В последние годы во избежание путаницы для обозначения соответствующих пространственных конфигураций символы d и l стремятся заменить символами D и L. Символы d и l предложено сохранить в их первоначальном значении для обозначения правого и левого вращения плоскости поляризации, наряду со знаками (+) и (—).
-диен — окончание для обозначения наличия двух двойных связей в молекуле, например пентадиен-1,3 СН3—СН=СН—СН=СН2.
-диин — окончание для обозначения наличия двух тройных связей в молекуле, например гексадиин-2,4 СН3—С≡С—С≡С—СН3.
-диол — окончание, характерное для названий двухатомных спиртов (гликолей), например гександиол-1,5 СН3СНОНСН2СН2СН2СН2ОН.
DL или dl — сокращения слов dexter — laevus (правый — левый) для обозначения рацемических смесей или соединений оптических антиподов.
-ен — окончание для названий углеводородов с двойной связью, например пентен-2 СН3СН=СНСН2СН3. По номенклатуре IUPAC 1957 это окончание имеют также ароматические углеводороды, например: бензен (бензол), толуен (толуол), нафтален (нафталин), фенантрен и т. д.
i — сокращение от inactive (неактивный). Приставка, показывающая, что вещество оптически недеятельно (рацемат, мезо-форма). В иностранной литературе часто встречается как сокращенное обозначение приставки изо- (см. ниже).
изо- — приставка, указывающая на разветвленное строение цепи атомов углерода.
-ил — окончание для названий одновалентных радикалов: метил СН3—, этил С2Н5—, пропил С3Н7— и т. д.
-илен — окончание для названий углеводородов этиленового ряда: этилен СН2=СН2, пропилен СН3СН=СН2 и т. д. Такое же окончание имеют и названия некоторых двухвалентных радикалов, например: метилен —СН2—; этилен — СН2—СН2—; триметилен — СН2—СН2—СН2— и т. п.
-илиден — окончание для названий двухвалентных радикалов: этилиден
Источник статьи: http://xumuk.ru/nomenklatura/2.html
Номенклатура органических соединений
С развитием химической науки и появлением большого числа новых химических соединений все более возрастала необходимость в разработке и принятии понятной ученым всего мира системы их наименования, т.е. номенклатуры. Далее приведем обзор oсновных номенклатур органических соединений.
Тривиальная номенклатура
В истоках развития oрганической химии новым сoединениям приписывали тривиальные названия, т.е. названия сложившиеся исторически и нередко связанные со способом их получения, внешним видом и даже вкусом и т.п. Такая номенклатура органических соединений называется тривиальной. В таблице ниже приведены некоторые из соединений, сохранивших свои названия и в нынешние дни.
Рациональная номенклатура
С расширением списка органических соединений, возникла необходимость связывать их название со строением. Базой рациональной номенклатуры органических соединений является наименование простейшего органического соединения. Например:
Однако, более сложным органическим соединениям невозможно приписать названия подобным способом. В этом случае следует называть соединения согласно правилам систематической номенклатуры ИЮПАК.
Систематическая номенклатура ИЮПАК
ИЮПАК (IUPAC) — Международный союз теоретической и прикладной химии (International Union of Pure and Applied Chemistry).
В данном случае, называя соединения, следует учитывать местоположение атомов углерода в молекуле и структурных элементов. Наиболее часто применяемой является заместительная номенклатура органических соединений, т.е. выделяется базовая основа молекулы, в которой атомы водорода замещены на какие-либо структурные звенья или атомы.
Прежде чем приступить к построению названий соединений, советуем выучить наименования числовых приставок, корней и суффиксов используемых в номенклатуре ИЮПАК.
А также названия функциональных групп:
Для обозначения числа кратных связей и функциональных групп пользуются числительными:
Далее приведены наименования радикалов:
Предельные углеводородные радикалы:
Непредельные углеводородные радикалы:
Ароматические углеводородные радикалы:
Кислородсодержащие радикалы:
Правила построения названия органического соединения по номенклатуре ИЮПАК:
Определить все присутствующие функциональные группы и их старшинство
Определить наличие кратных связей
- Пронумеровать главную цепь, причем нумерацию следует начинать с наиболее близкому к старшей группе конца цепи. При существовании нескольких таких возможностей, нумеруют цепь так, чтобы минимальный номер получили или кратная связь, или другой заместитель, присутствующий в молекуле.
Карбоциклические соединения нумеруют начиная со связанного со старшей характеристической группой атома углерода. При наличии двух и более заместителей цепь стараются пронумеровать так, чтобы заместителям принадлежали минимальные номера.
- Составить название соединения:
— Определить основу названия соединения, составляющего корень слова, который обозначает предельный углеводород с тем же количеством атомов, что и главная цепь.
— После основы названия следует суффикс, показывающий степень насыщенности и количество кратных связей. Например, — тетраен, — диен. При отсутствии кратных связей используют суффикс – ск.
— Далее арабскими цифрами показывают местоположение кратных связей. Например, гексин – 2.
— Затем, также в суффикс добавляется наименование самой старшей функциональной группы.
— После следует перечисление заместителей в алфавитном порядке с указанием их местоположения арабской цифрой. Например, — 5-изобутил, — 3-фтор. При наличии нескольких одинаковых заместителей указывают их количество и положение, например, 2,5 – дибром-, 1,4,8-тримети-.
Следует учесть, что цифры отделяются от слов дефисом, а между собой – запятыми.
В качестве примера дадим название следующему соединению:

Определяем другие функциональные группы: — ОН, — Сl, — SH, — NH2.
Кратных связей нет.
2. Нумеруем главную цепь, начиная со старшей группы.
3. Число атомов в главной цепи – 12. Основа названия – метиловый эфир додекановой кислоты.
Далее обозначаем и называем все функциональные группы в алфавитном порядке:
10-амино-6-гидрокси -7-хлоро-9-сульфанил-метиловыйэфир додекановой кислоты.
10-амино-6-гидрокси-7-хлоро-9-сульфанил-метилдодеканоат
Номенклатура оптических изомеров
- В некоторых классах соединений, таких как альдегиды, окси- и аминокислоты для обозначения взаимного расположения заместителей используют D,L – номенклатуру. Буквой D обозначают конфигурацию правовращающего изомера, L – левовращающего.
В основе D,L-номенклатуры органических соединений лежат проекции Фишера:
- чтобы определить конфигурации изомеров α-аминокислот и α- оксикислот вычленяют «оксикислотный ключ», т.е. верхние части их проекционных формул. Если гидроксильная (амино-) группа расположена справа, то это D-изомер, слева L-изомер.
Например, представленная ниже винная кислота имеет D — конфигурацию по оксикислотному ключу:
- чтобы определить конфигурации изомеров сахаров вычленяют «глицериновый ключ», т.е. сравнивают нижние части (нижний асимметрический атом углерода) проекционной формулы сахара с нижней частью проекционной формулы глицеринового альдегида.
Обозначение конфигурации сахара и направление вращения аналогично конфигурации глицеринового альдегида, т.е. D – конфигурации соответствует расположение гидроксильной группы расположена справа, L – конфигурации – слева.
Так, например, ниже представлена D-глюкоза.
2) R -, S-номенклатура (номенклатура Кана, Ингольда и Прелога)
В данном случае заместители при асимметрическом атоме углерода располагаются по старшинству. Оптических изомеры имеют обозначения R и S, а рацемат — RS.
Для описания конфигурации соединения в соответствии с R,S-номенклатурой поступают следующим образом:
- Определяют все заместители у асимметричного атома углерода.
- Определяют старшинство заместителей, т.е. сравнивают их атомные массы. Правила определения ряда старшинства те же, что и при использовании E/Z-номенклатуры геометрических изомеров.
- Ориентируют в пространстве заместители так, чтобы младший заместитель (обычно водород) находился в наиболее отдаленном от наблюдателя углу.
- Определяют конфигурацию по расположению остальных заместителей. Если движение от старшего к среднему и далее к младшему заместителю (т.е. в порядке уменьшения старшинства) осуществляется по часовой стрелке, то это R конфигурация, против часовой стрелки — S-конфигурация.
В таблице ниже приведен перечень заместителей, расположенных в порядке возрастания их старшинства:
Источник статьи: http://zadachi-po-khimii.ru/organic-chemistry/nomenklatura-organicheskix-soedinenij.html