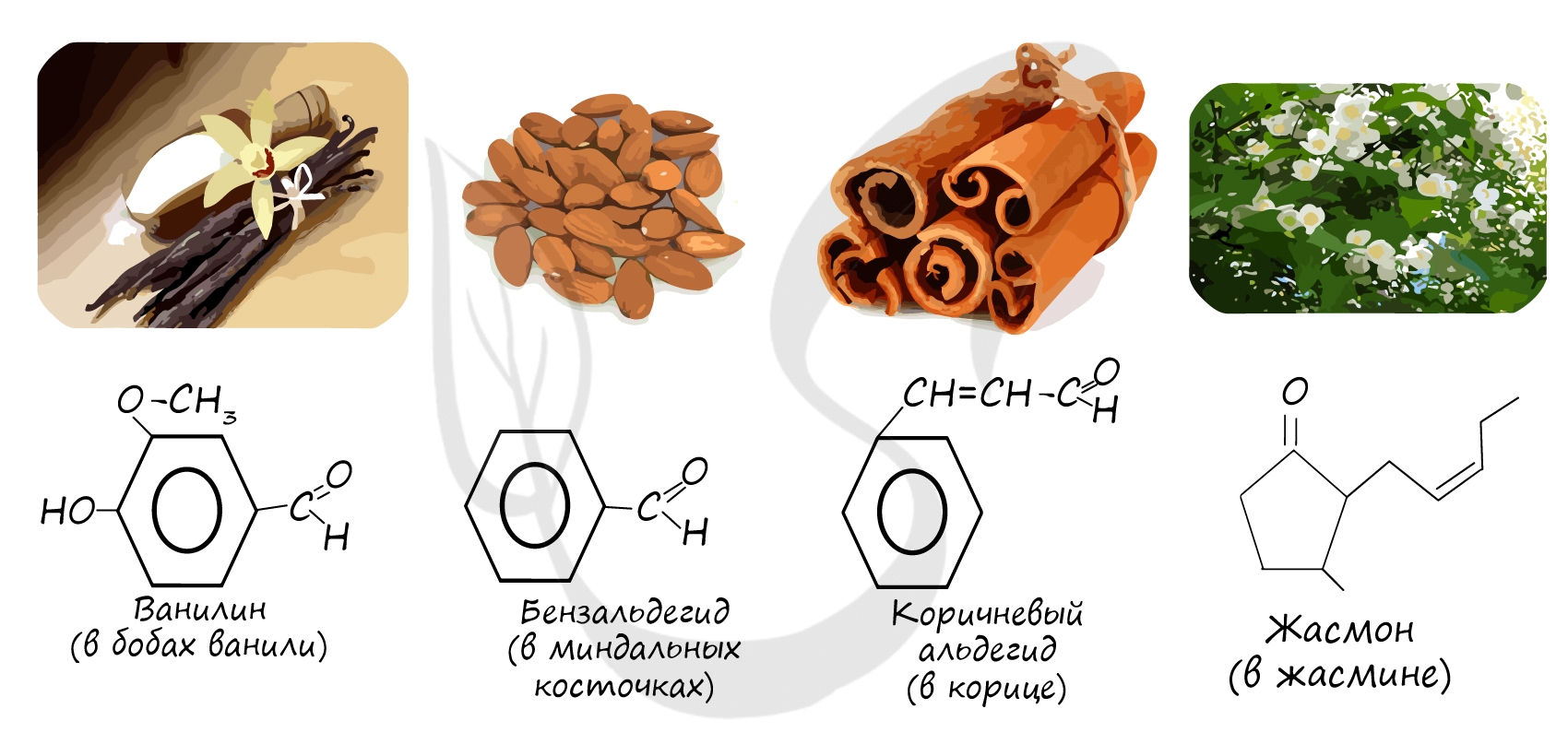
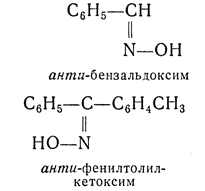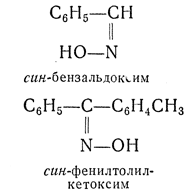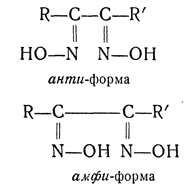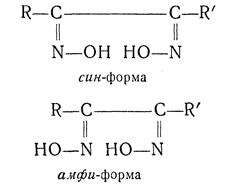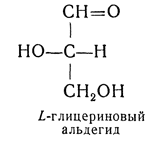Некоторые важнейшие приставки (префиксы) и окончания (суффиксы)
-аза — окончание в названиях энзимов или ферментов (мальтаза, амилаза, лактаза); присоединяется к названию (или корню названия) вещества, на которое действует энзим.
алло- — приставка, обозначающая, что данное соединение по химическому строению сходно с другим. Например, кофеин и аллокофеин. В случаях геометрической изомерии соединений с двойной связью обозначает более стабильную форму, в которую соединение превращается при нагревании: фумаровую кислоту можно назвать алломалеиновой, так как она является более стабильным изомером, образующимся при нагревании малеиновой кислоты.
-ал — окончание названий альдегидов по Женевской и Льежской номенклатурам.
амфи- — приставка, обозначающая положения 2,6 для двузамещенных нафталина. Применяется также для наименования некоторых стереоизомеров диоксимов (см. анти-).
-ан — окончание названий предельных (парафиновых) углеводородов.
ана- — приставка для обозначения 1,5-двузамещенных нафталина.
анти- — приставка, применяемая для обозначения стереоизомеров. Например, антивинная (мезовинная) кислота. Часто также применяется для обозначения стереоизомерных оксимов и гидразонов и указывает на диагональное расположение групп по отношению к плоскости двойной связи; в противоположность этому приставкой син- в ряду оксимов и гидразонов обозначают одностороннее расположение групп:
В ряду диоксимов кроме анти- и син-форм возможны еще амфи-формы:
(ср. также транс- и цис-).
аци- — приставка, обозначающая кислотную таутомерную форму нитросоединений.
би- — приставка, обозначающая удвоение радикала, например: бифенил.
бис-, трис-, тетракис- — приставки, указывающие на наличие двух, трех, четырех и т. д. сложных радикалов, например: бис-(диметиламино)-этан.
виц- — сокращение от вицинальный (соседний, рядовой).
втор- — сокращение от вторичный.
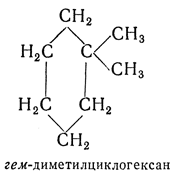
гем- — приставка, обозначающая (для полиметиленовых, динитро- и др. соединений) замещение двух атомов водорода у одного и того же атома углерода. Например:
гомо- — наиболее часто — приставка для обозначения гомологов, которые отличаются на одну группу СН2. Например, салициловая кислота С6Н4(ОН)СООН и гомосалициловая кислота С6Н4(ОН)СН2СООН, цистеин CH2(SH)CH(NH2)COOH и гомоцистеин CH2(SH)CH2CH(NH2)COOH.
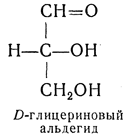
D — обозначение (от слова dexter — правый), указывающее на принадлежность одного из пары зеркальных изомеров (энантиомеров) к ряду соединений с определенной пространственной конфигурацией (D-ряд, или ряд D-глицеринового альдегида). Зеркальные изомеры с противоположной пространственной конфигурацией обозначают символом L (от слова laevus— левый), что также указывает на принадлежность их к стерическому ряду (L-ряд, или ряд L-глицеринового альдегида). Проекционные формулы зеркально-изомерных глицериновых альдегидов:
d — сокращение от слова dexter (правый); первоначально применялось для обозначения оптически активных соединений, вызывающих правое вращение плоскости поляризации света; оптические антиподы, вызывающие левое вращение, обозначали символом l — сокращение от слова laevus (левый). Затем символы d и l стали применять для обозначения принадлежности зеркальных изомеров по их пространственным конфигурациям к определенным стерическим рядам, и в этом значении они встречаются в литературе, наряду с символами D и L (d-ряд или D-ряд; l-ряд или L-ряд, см. выше). В последние годы во избежание путаницы для обозначения соответствующих пространственных конфигураций символы d и l стремятся заменить символами D и L. Символы d и l предложено сохранить в их первоначальном значении для обозначения правого и левого вращения плоскости поляризации, наряду со знаками (+) и (—).
-диен — окончание для обозначения наличия двух двойных связей в молекуле, например пентадиен-1,3 СН3—СН=СН—СН=СН2.
-диин — окончание для обозначения наличия двух тройных связей в молекуле, например гексадиин-2,4 СН3—С≡С—С≡С—СН3.
-диол — окончание, характерное для названий двухатомных спиртов (гликолей), например гександиол-1,5 СН3СНОНСН2СН2СН2СН2ОН.
DL или dl — сокращения слов dexter — laevus (правый — левый) для обозначения рацемических смесей или соединений оптических антиподов.
-ен — окончание для названий углеводородов с двойной связью, например пентен-2 СН3СН=СНСН2СН3. По номенклатуре IUPAC 1957 это окончание имеют также ароматические углеводороды, например: бензен (бензол), толуен (толуол), нафтален (нафталин), фенантрен и т. д.
i — сокращение от inactive (неактивный). Приставка, показывающая, что вещество оптически недеятельно (рацемат, мезо-форма). В иностранной литературе часто встречается как сокращенное обозначение приставки изо- (см. ниже).
изо- — приставка, указывающая на разветвленное строение цепи атомов углерода.
-ил — окончание для названий одновалентных радикалов: метил СН3—, этил С2Н5—, пропил С3Н7— и т. д.
-илен — окончание для названий углеводородов этиленового ряда: этилен СН2=СН2, пропилен СН3СН=СН2 и т. д. Такое же окончание имеют и названия некоторых двухвалентных радикалов, например: метилен —СН2—; этилен — СН2—СН2—; триметилен — СН2—СН2—СН2— и т. п.
-илиден — окончание для названий двухвалентных радикалов: этилиден
Источник статьи: http://xumuk.ru/nomenklatura/2.html
Органическая химия 9 класс
На самом деле современная номенклатура органических соединений очень логична. Начнем сначала:
1) практически все названия классов орг. соединений начинаются с основны «алк» (алканы, алканолы (спирты) и т. д. ) Эта основа переводится как «углеводород»
2) после основы следует суффикс — он обозначает особенности строения данного вещества — функциональную группу или тип связи (двойную, тройную и др. ) Суффиксы и соответсвующие им особенности необходимо просто выучить (-ен — двойная связь, группа -ОН — суффикс -ол — спирты и т. д. ) — несомненно, схему на уроке давали.
3) Пример 1
Н3С — СН2 — СН2 — СООН
Рассмотрим данное соединение
Основа названия — бутан (4 углеродных атома, суффикс -АН, поскольку все связи одинаковые)
В соединении присутствует группа -СООН — карбоксильная — она соответствует карбоновым кислотам, и обозначается суффиксом -ОВАЯ
соединяем сонову названия и суффикс, получается бутановая кислота.
Пример 2
Н2С = СН — СН2 — ОН
Основа названия пропан (3 углеродных атома) , но, поскольку присутсвует двойная связь (которая обозначается суффиксом — ЕН) , меняем суффикс на -ЕН — ПРОПЕН
функциональная группа — ОН (обозначается суффиксом -ОЛ — класс спирты)
соединяем основу названия и суффикс — ПРОПЕНОЛ
В общем, учим названия классов соединей и их обозначения с помощью суффиксов и тренируемся на конкретных примерах.
Источник статьи: http://otvet.mail.ru/question/57985562
Альдегиды
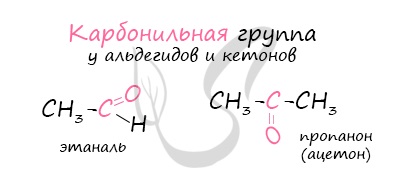
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
Номенклатура и изомерия альдегидов
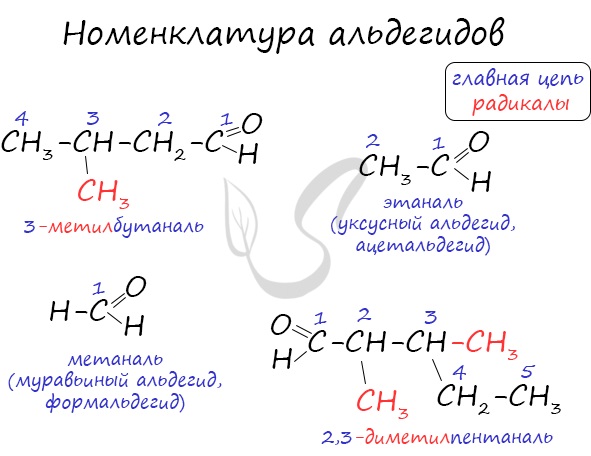
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
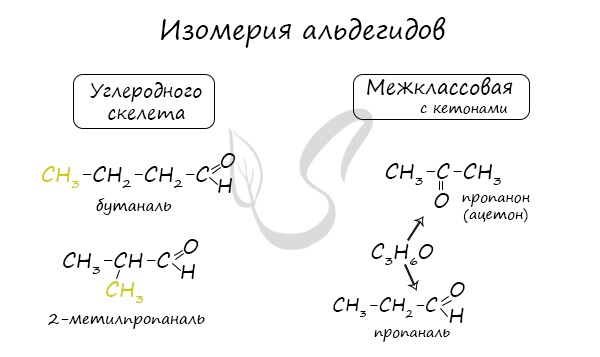
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
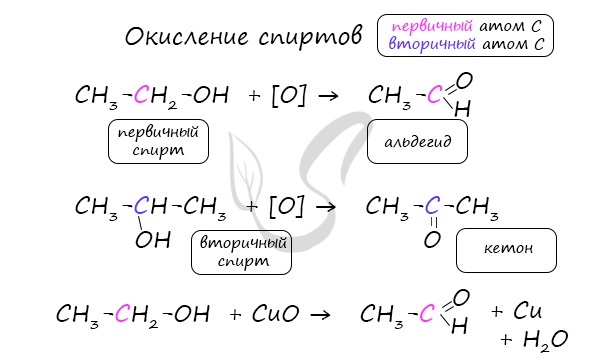
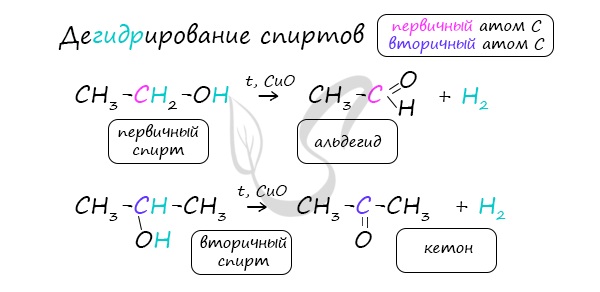
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
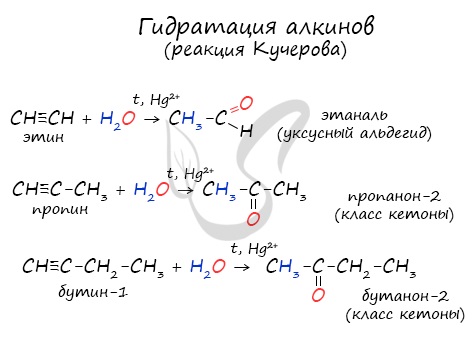
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
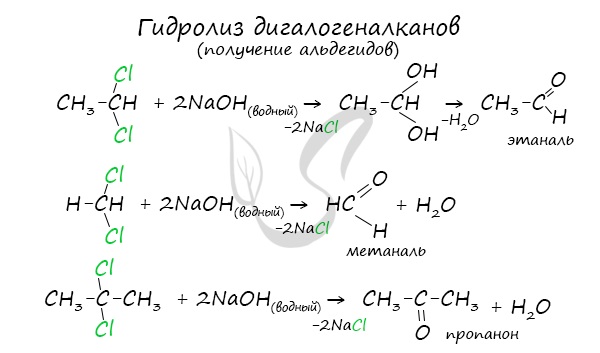
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
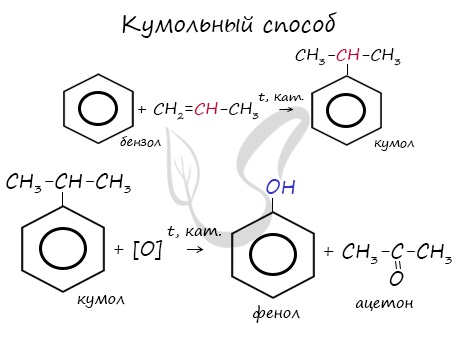
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
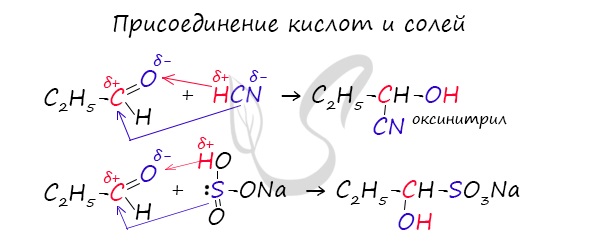
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
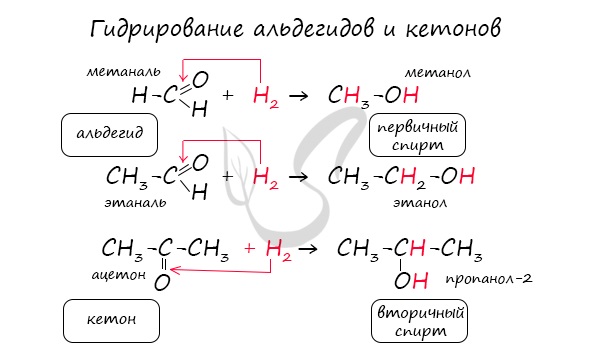
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.
Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник статьи: http://studarium.ru/article/189