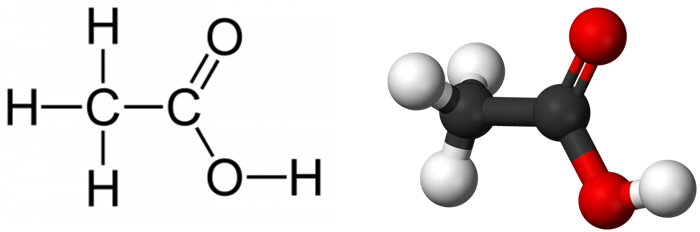
Формула уксусной кислоты
Химическая и структурная формулы уксусной кислоты
Химическая формула: CH3COOH
Молярная масса: 60,05 г/моль.
Уксусная кислота – предельная одноосновная карбоновая кислота. Образует соли – ацетаты.
Слабая кислота, константа диссоциации Ka=1,75 •10 –5 , рКа = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота — бесцветная жидкость с резким характерным запахом, кислым вкусом. Гигроскопична, неограниченно растворяется в воде. Существует в виде димеров. Безводная уксусная кислота называется ледяной, поскольку при замерзании образует льдовидную массу.
Химические свойства уксусной кислоты
Уксусная кислота проявляет все основные свойствами карбоновых кислот.
- Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
Взаимодействует с оксидами металлов:
Взаимодействует с гидроксидами металлов:
В присутствии серной кислоты вступает в реакцию этерификации с образованием сложных эфиров:
Вступает в реакции галогенирования с образованием галогенуксусных кислот:
Качественной реакцией на соли уксусной кислоты является взаимодействие с сильными кислотами. Уксусная кислота слабая и вытесняется сильными кислотами из растворов солей, при этом появляется ее характерный запах:
Получение. Наиболее экономически выгодный промышленный способ получения уксусной кислоты – карбонилирование метанола моноксидом углерода, катализатор – соли родия, промотор – иодид-ионы:
Биохимический способ – окисление этанола:
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), бытовой кулинарии, и консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, в качестве растворителя.
Концентрированная уксусная кислота (с концентрацией более 30%) способна вызывать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей
Примеры решения задач
| Задание | Вычислите рН раствора уксусной кислоты с молярной концентрацией 1 моль/л, константа диссоциации которой равна 1,75 • 10 –5 . |
| Решение | Запишем уравнение диссоциации уксусной кислоты: |
Константа диссоциации кислоты:
Обозначим за х концентрацию ионов водорода х = [H + ], тогда выражение для константы диссоциации примет вид:
Поскольку уксусная кислота – слабая, то x + . Поскольку х = [H + ], то
| Задание | Вычислить pH раствора, полученного при добавлении к 10 мл 0,1 М раствора уксусной кислоты 5 мл 0,1 М раствора гидроксида натрия. Константа диссоциации уксусной кислоты Kа = 1,75 •10 –5 . |
| Решение | Суммарный объем раствора будет равен: |



При сливании растворов протекает реакция:
Рассчитаем количества вещества уксусной кислоты и гидроксида натрия:








По уравнению реакции n(CH3COOH) = n(NaOH), а в нашем случае n(CH3COOH) > n(NaOH), следовательно, уксусная кислота взята в избытке. После протекания реакции в растворе будут находиться уксусная кислота и ацетат натрия, т.е. мы получили буферную систему.
Рассчитаем концентрацию ацетата натрия в полученном растворе:


Концентрация уксусной кислоты в растворе будет равна:




Концентрация ионов водорода в буферном растворе рассчитывается по формуле:
где Ka – константа диссоциации уксусной кислоты.

Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-uksusnoj-kisloty/
Формула уксусной кислоты
Уксусная кислота (этановая кислота, метанкарбоновая кислота) представляет собой органическое вещество с формулой \(\ \mathrm
Химические и структурные формулы уксусной кислоты
Химическая формула: \(\ \mathrm
Валовая формула: \(\ \mathrm
Структурно-химическая формула уксусной кислоты
Молярная масса: 60,05 г / моль.
Уксусная кислота является терминальной одноосновной карбоновой кислотой. Соли формы — ацетаты.
Слабая кислота, константа диссоциации Ka = 1,75 • 10-5, pKa = 4,76.
Физические свойства уксусной кислоты
Уксусная кислота представляет собой бесцветную жидкость с острым характерным запахом, кислым вкусом. Гигроскопично, растворим в воде на неопределенный срок. Существует в виде димеров. Безводная уксусная кислота называется льдом, потому что она образует ледяную массу, когда она замерзает.
Химические свойства уксусной кислоты
Уксусная кислота обладает всеми основными свойствами карбоновых кислот.
Взаимодействует с активными металлами с образованием водорода и соответствующих солей (ацетатов):
\(\ M g+2 C H_ <3>\operatorname
Взаимодействует с оксидами металлов:
Взаимодействует с гидроксидами металлов:
\(\ \mathrm
В присутствии серной кислоты происходит реакция этерификации с образованием сложных эфиров:
\(\ \mathrm
Он входит в реакции галогенирования с образованием галогенуксусных кислот:
\(\ \mathrm
Качественная реакция на соли уксусной кислоты представляет собой взаимодействие с сильными кислотами. Уксусная кислота слабая и замещается сильными кислотами из солевых растворов, в то время как характерный запах появляется:
Чек. Наиболее экономически выгодным промышленным способом получения уксусной кислоты является карбонилирование метанола монооксидом углерода, катализатором являются родиевые соли, а промотором являются иодидные ионы:
\(\ \mathrm
Биохимический метод — окисление этанола:
\(\ \mathrm
Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260), домашняя кулинария и консервирование. Уксусная кислота используется для получения лекарственных и ароматических веществ в качестве растворителя.
Концентрированная уксусная кислота (с концентрацией более 30%) может вызвать химические ожоги. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей
Рассчитать \(\ \mathrm
Напишите уравнение диссоциации для уксусной кислоты:
Константа диссоциации кислоты:
Обозначим через \(\ x \) концентрацию ионов водорода \(\ x=[\mathrm
Поскольку уксусная кислота слабая, \(\ x ПРИМЕР 2
Рассчитать \(\ \mathrm
Общий объем решения будет равен:
При осушении растворов происходит реакция:
Рассчитайте количество вещества уксусной кислоты и гидроксида натрия:
\(\ n_<\mathrm<исх>>\left(\mathrm
Согласно уравнению реакции \(\ \mathrm
Рассчитайте концентрацию ацетата натрия в полученном растворе:
\(\ n\left(C H_ <3>C O O N a\right)=n(N a O H)=0,0005моль \)
\(\ C\left(C H_ <3>C O O N a\right)=n\left(C H_ <3>C O O N a\right) / V=0,0005 / 0,015=0,033моль/л \)
Концентрация уксусной кислоты в растворе будет равна:
\(\ n\left(C H_ <3>C O O H\right)= n_<исх>\left(C H_ <3>C O O H\right) -n_<исх>(N a O H) =0,001-0,0005=0,0005моль \)
\(\ C\left(C H_ <3>C O O\right)=n\left(C H_ <3>C O O\right) / V=0,0005 / 0,015=0,033 моль/л \)
Концентрация ионов водорода в буферном растворе рассчитывается по формуле:
где Ka — константа диссоциации уксусной кислоты.
Рассчитайте \(\ \mathrm
\(\ p H=-l g\left[H^<+>\right]=-l g\left(1,74 \cdot 10^<-5>\right)=4,76 \)
Источник статьи: http://sciterm.ru/spravochnik/formula-uksusnoj-kisloti/
Химические свойства уксусной кислоты
Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см 3 ;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
Взаимодействие
Что образуется
С неметаллами (реакция замещения)
Органическая и неорганическая кислоты
– CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl;
– CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF;
– CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI
С кислородом (реакция окисления)
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Применение
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.
Рис. 3. Использование уксусной кислоты.
Что мы узнали?
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 331.
Не понравилось? — Напиши в комментариях, чего не хватает.
Содержание
Бонус
- Неметаллы
- Химические свойства неметаллов
- Получение водорода
- Получение кислорода Химические свойства уксусной кислоты
- Аммиак
- Получение аммиака
- Окисление аммиака
- Фосфор
- Химические свойства фосфора
- Адсорбция
- Природные источники углеводородов
- Кристаллогидраты
- Круговорот азота в природе
- Круговорот углерода в природе
- Аллотропные модификации углерода
- Силикатная промышленность
- Сульфиды
- Сера
- Алкены
- Сероводород
- Озон
- Азот
- Раствор аммиака
- Кремний
- Оксид азота
- Химические свойства алканов
- Формула алканов
- Алканы
- Получение азотной кислоты
- Химические свойства кремния
- Соединения кремния
- Валентность кремния
- Непредельные углеводороды
- Предмет органической химии
- Азотная кислота
- Применение кислорода
- Химические свойства серной кислоты
показать все
По многочисленным просьбам теперь можно: сохранять все свои результаты, получать баллы и участвовать в общем рейтинге.
- 1.
Игорь Проскуренко 279
- 2.
Сергей Наумов 258
- 3.
Igor S 244
- 4.
Даниил Васильев 215
- 5.
aleqsandr sagrishvili 149
- 6.
Михаил Азрапкин 142
- 7.
Ульяна Потапкина 136
- 8.
Александр С 124
- 9.
Алсу Сакаева 118
- 10.
Der Pro 113
- 1.
Кристина Волосочева 19,120
- 2.
Ekaterina 18,721
- 3.
Юлия Бронникова 18,580
- 4.
Darth Vader 17,856
- 5.
Алина Сайбель 16,787
- 6.
Мария Николаевна 15,775
- 7.
Лариса Самодурова 15,735
- 8.
Игорь Проскуренко 15,483
- 9.
Liza 15,165
- 10.
TorkMen 14,876
Самые активные участники недели:
- 1. Виктория Нойманн — подарочная карта книжного магазина на 500 рублей.
- 2. Bulat Sadykov — подарочная карта книжного магазина на 500 рублей.
- 3. Дарья Волкова — подарочная карта книжного магазина на 500 рублей.
Три счастливчика, которые прошли хотя бы 1 тест:
- 1. Наталья Старостина — подарочная карта книжного магазина на 500 рублей.
- 2. Николай З — подарочная карта книжного магазина на 500 рублей.
- 3. Давид Мельников — подарочная карта книжного магазина на 500 рублей.
Карты электронные(код), они будут отправлены в ближайшие дни сообщением Вконтакте или электронным письмом.
Источник статьи: http://obrazovaka.ru/himiya/himicheskie-svoystva-uksusnoy-kisloty-poluchenie.html

















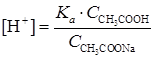




 Игорь Проскуренко 279
Игорь Проскуренко 279