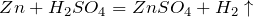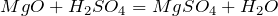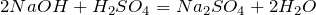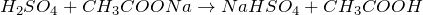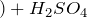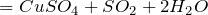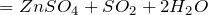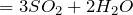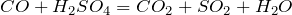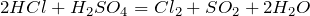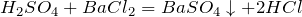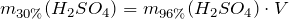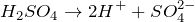Как в химии пишется серная кислота
Бесцветная летучая маслянистая жидкость, t °пл. = 17° C ; t °кип. = 66°С; на воздухе «дымит», сильно поглощает влагу (хранят в запаянных сосудах).
SO 3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
1) 2 SO 2 + O 2 → 2 SO 3 (катализатор – V 2 O 5 , при 450˚С)
1) Серный ангидрид — кислотный оксид.
При растворении в воде дает сильную двухосновную серную кислоту:
Диссоциация протекает ступенчато:
H 2 SO 4 → H + + HSO 4 — (первая ступень, образуется гидросульфат – ион)
HSO 4 — → H + + SO 4 2- (вторая ступень, образуется сульфат – ион)
H 2 SO 4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
Взаимодействие со щелочами
NaOH + SO 3 (избыток) → NaHSO 4
Взаимодействие с основными оксидами
Тяжелая маслянистая жидкость («купоросное масло»); r = 1,84 г/см 3 ; нелетучая, хорошо растворима в воде – с сильным нагревом; t °пл. = 10,3° C , t °кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду, а не наоборот!
Производство серной кислоты
1-я стадия. Печь для обжига колчедана
1) измельчение железного колчедана (пирита)
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V 2 O 5 ):
3-я стадия . Поглотительная башня
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Химические свойства разбавленной серной кислоты
H 2 SO 4 — сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
1) Диссоциация протекает ступенчато:
H 2 SO 4 → H + + HSO 4 — (первая ступень, образуется гидросульфат – ион)
HSO 4 — → H + + SO 4 2- (вторая ступень, образуется сульфат – ион)
H 2 SO 4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
3) Взаимодействие с основными и амфотерными оксидами:
4) Взаимодействие с основаниями:
· H 2 SO 4 + 2 NaOH → Na 2 SO 4 + 2 H 2 O (реакция нейтрализации)
Если кислота в избытке, то образуется кислая соль:
2 H + + Cu ( OH )2 → Cu 2+ + 2 H 2 O
5) Обменные реакции с солями:
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
образование газа — как сильная нелетучая кислота серная вытесняет из солей другие менее сильные кислоты, например, угольную
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (получение этанола);
- сульфирования (получение СМС и промежуточные продукты в производстве красителей);
- и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P ₂ O ₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH ₄ ) ₂ SO ₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Применение солей серной кислоты
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.
«Бариевая каша» BaSO4 обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
Источник статьи: http://www.sites.google.com/site/himulacom/zvonok-na-urok/9-klass—vtoroj-god-obucenia/urok-no20-oksid-sery-vi-sernaa-kislota-i-eee-soli
Серная кислота — химические свойства и промышленное производство

Тяжелая маслянистая жидкость («купоросное масло»);
плотность 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Теплота гидратации настолько велика, что смесь может вскипать, разбрызгиваться и вызывать ожоги. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении воды к кислоте более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота.
Промышленное производство серной кислоты (контактный способ):

Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора V 2 O 5 ( пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С ( т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3
Химические свойства серной кислоты:
H2SO4 — сильная двухосновная кислота, одна из самых сильных минеральных кислот, из-за высокой полярности связь Н – О легко разрывается.
1) В водном растворе серная кислота диссоциирует, образуя ион водорода и кислотный остаток:
H2SO4 = H + + HSO4 — ;
HSO4 — = H + + SO4 2- .
Суммарное уравнение:
H2SO4 = 2H + + SO4 2- .
2) Взаимодействие серной кислоты с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + H2 +1 SO4(разб) → Zn +2 SO4 + H2
3) Взаимодействие серной кислоты с основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
5) Обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для обнаружения серной кислоты и растворимых сульфатов (качественная реакция на сульфат ион).
Особые свойства концентрированной H2SO4 :
1) Концентрированная серная кислота является сильным окислителем; при взаимодействии с металлами (кроме Au, Pt) восстанавливаться до S +4 O2, S 0 или H2S -2 в зависимости от активности металла. Без нагревания не реагирует с Fe, Al, Cr – пассивация. При взаимодействии с металлами, обладающими переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты: Fe 0 → Fe 3+ , Cr 0 → Cr 3+ , Mn 0 → Mn 4+ ,Sn 0 → Sn 4+
Активный металл
8 Al + 15 H2SO4(конц.)→4Al2(SO4)3 + 12H2O + 3 H2S
4│2Al 0 – 6e — → 2Al 3+ — окисление
3│ S 6+ + 8e → S 2– восстановление
Металл средней активности
2Cr + 4 H2SO4(конц.)→ Cr2(SO4)3 + 4 H2O + S
1│ 2Cr 0 – 6e →2Cr 3+ — окисление
1│ S 6+ + 6e → S 0 – восстановление
Металл малоактивный
2Bi + 6H2SO4(конц.)→ Bi2(SO4)3 + 6H2O + 3 SO2
1│ 2Bi 0 – 6e → 2Bi 3+ – окисление
3│ S 6+ + 2e →S 4+ — восстановление
2) Концентрированная серная кислота окисляет некоторые неметаллы как правило до максимальной степени окисления, сама восстанавливается до S +4 O2:
3) Окисление сложных веществ:
Серная кислота окисляет HI и НВг до свободных галогенов:
2 КВr + 2Н2SO4 = К2SО4 + SO2 + Вr2 + 2Н2О
2 КI + 2Н2SО4 = К2SO4 + SO2 + I2 + 2Н2О
Концентрированная серная кислота не может окислить хлорид-ионы до свободного хлора, что дает возможность получать НСl по реакции обмена:
NаСl + Н2SO4(конц.) = NаНSO4 + НСl
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Обугливание сахара, целлюлозы, крахмала и др. углеводов при контакте с серной кислотой объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑.
Источник статьи: http://himege.ru/sernaya-kislota-ximicheskie-svojstva-i-promyshlennoe-proizvodstvo/
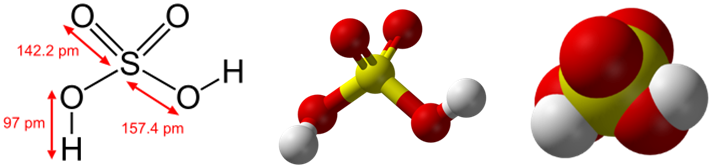
Формула серной кислоты
Химическая и структурная формула серной кислоты
Химическая формула: H2SO4
Молекулярная масса: 98,078г/моль.
Физические свойства серной кислоты
При обычных условиях – тяжёлая маслянистая жидкость без цвета и запаха (может иметь желтоватый оттенок), с кислым «медным» вкусом. Температура кристаллизации чистой серной кислоты +10°С.
Неограниченно смешивается с водой с выделением большого количества тепла, поэтому во избежание «вскипания» раствора всегда следует добавлять серную кислоту в воду, а не наоборот.
Раствор SO3 в серной кислоте называется олеум. Олеум содержит пиросерные кислоты, образующиеся по реакциям:
Серная кислота – сильная кислота, константа диссоциации Ка = 10 3 . Образует средние и кислые соли – сульфаты и гидросульфаты.
Химические свойства серной кислоты
Разбавленная серная кислота проявляет типичные свойства кислот:
- реагирует с металлами, находящимися в электрохимическом ряду напряжений до водорода с образованием сульфатов и выделением водорода:
реагирует с основными оксидами:
и с основаниями с образованием соответствующей соли и воды:
вытесняет более слабые кислоты из их солей:
Концентрированная серная активно поглощает пары воды, способна вытеснять воду из органических соединений, с образованием углерода, воды и выделением тепла (обугливание сахара):
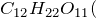
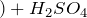
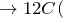
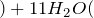
Концентрированная серная кислота – очень сильный окислитель:
окисляет металлы, вне зависимости от их положения в ряду напряжений (кроме золота и платины) восстанавливаясь при этом до SO2. Выделения водорода не происходит.
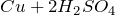
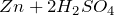
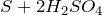
с кислотами – неокислителями:
Качественная реакция на сульфат-ион – взаимодействие с растворимыми солями бария, с образованием нерастворимого в воде и кислотах белого осадка сульфата бария:
Концентрированная серная кислота – очень едкое вещество. При попадании на живые ткани дегидрирует углеводороды, выделяя избыточное тепло, что приводит к вторичному термическому ожогу, дополнительно к химическому ожогу. Поэтому повреждения, вызываемые серной кислотой, потенциально более опасны, чем повреждения, вызванные другими кислотами.
Примеры решения задач
| Задание | Рассчитать, сколько мл 96%-ного раствора серной кислоты с плотностью 1,8355 г/см  необходимо взять для приготовления одного литра 30%-ного раствора (плотность 1,219 г/см необходимо взять для приготовления одного литра 30%-ного раствора (плотность 1,219 г/см )? )? |
| Решение | Масса серной кислоты в 1 л 30%-ного раствора равна: |
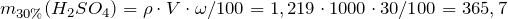
Масса серной кислоты в 1 мл 96%-ного раствора равна:
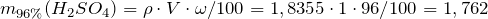
Объем 96%-ного раствора серной кислоты будет равен:
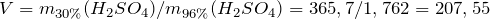
| Задание | К 3 л воды прибавили 2 мл 96% серной кислоты, плотность которой равна 1,84 г/мл. Вычислить pH полученного раствора. |
| Решение | Серная кислота – сильная кислота, в растворе полностью диссоциирует на ионы: |
Рассчитаем массу раствора серной кислоты:
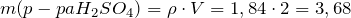
Рассчитаем массу серной кислоты в растворе:
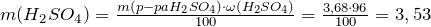
Молярная масса серной кислоты равна 98 г/моль.
Найдем количество вещества серной кислоты в растворе:
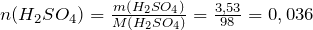
Суммарный объем раствора будет равен:
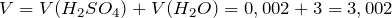
Рассчитаем молярную концентрацию серной кислоты:

Из уравнения реакции диссоциации серной кислоты следует, что концентрация ионов водорода равна:
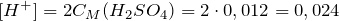
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-sernoj-kisloty/