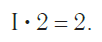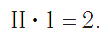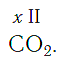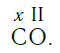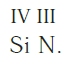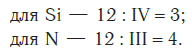Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
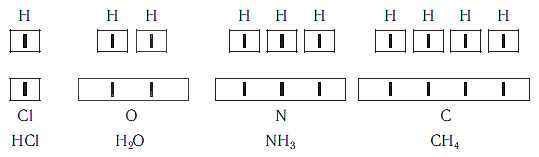
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
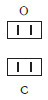
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
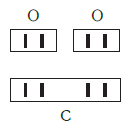
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
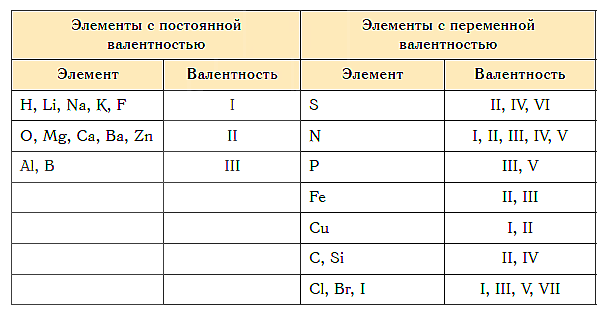
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-6-valentnost.html
Валентность — это просто
От слова «валентность» многие ученики, изучающие химию в 8 классе, впадают в спячку. В школьном курсе химии этому вопросу уделяется не так много времени, хотя валентность – одно их базовых понятий в этой науке. Очень важно досконально разобраться, что такое валентность , как она определяется и какое значение она имеет. Поняв это и научившись составлять формулы и определять валентность элементов, вы существенно облегчите себе изучение химии. Приступаем.
Что же такое валентность? Ничего страшного в этом явлении нет.
Валентность – это способность атома образовывать химические связи.
Вы же знаете, что бывают вещества простые, состоящие из атомов одного вида, и сложные, состоящие из атомов разных элементов? Так вот чтобы атомы как-то соединялись между собой, они должны связываться, соединяться. А соединяются они посредством химической связи . Одни атомы могут образовать только одну связь, на большее у них способностей не хватает. Другие атомы куда мощнее, они могут и несколько связей образовать, чтобы покрепче держаться за окружение. Вот представьте, что у вас только один друг. Надёжный такой, верный друг, который с вами в огонь и в воду. Вы с ним всегда в паре ходите. Это значит, что у вас валентность I (внимание! Читается это не «первая валентность», а «валентность один»!). А теперь представьте, что у вас три верных друга. Вы всегда за них держитесь и твёрдо уверены, что они при вас ежеминутно. Значит, у вас валентность III. В первом случае вы образовали одну крепкую связь, а во втором – три. Вот и вся валентность.
Любой учитель и репетитор по химии скажет вам, что
есть элементы с валентностью постоянной и элементы, у которых валентность может быть разной.
И, как ни странно, они будут правы. Если мы возвратимся к примерам с друзьями, то выглядеть это будет так. Кто-то всю жизнь дружит с одним человеком (у него всегда валентность I), кто-то всю жизнь дружит с тремя (валентность III). А кто-то иногда дружит с одним, иногда с тремя, а иногда — вообще с пятью! Встречали таких в жизни? Вот и среди химических элементов есть такие, которые иногда имеют валентность I, иногда валентность III или даже V. Должна вас немного расстроить: элементы с постоянной валентностью придётся зазубрить . Также навсегда запоминаем, что валентность обозначается римскими цифрами (так повелось, просто смиритесь с этим. Указывается валентность НАД элементом в формуле). Итак, наизусть нужно выучить, что:
· Металлы основной подгруппы первой группы всегда имеют валентность I. Это элементы Li, Na, K, Rb, Cs, Fr.
· Металлы основной подгруппы второй группы всегда имеют валентность II. Это элементы Be, Mg, Ca, Sr, Ba, Ra.
· Водород всегда имеет валентность I.
· Кислород всегда имеет валентность II.
· Элементы Al и В (основная группа третьей подгруппы) всегда имеют валентность III.
· Элементы основной подгруппы седьмой группы чаще (но не всегда!) имеют валентность I. Это элементы F, Cl, Br, I, At. Кстати, эти элементы носят название «галогены» и будьте настороже: галогены любят подшутить и иногда имеют другую валентность. В школьной химии обычно они представляются как одновалентные, но это кокетство, потому что галогены – шалуны.
Теперь перейдём к элементам с валентностью непостоянной. Это хулиганы, которые любят загадывать загадки и разыгрывать начинающих. Особое коварство они проявляют во время ЕГЭ по химии и даже ОГЭ по химии, запутывая бедных школьников. Итак,
запомните этих головорезов с непостоянной валентностью в лицо:
C (углерод), N (азот), P (фосфор), S (сера), Сr (хром), Fe (железо), Cu (медь).
Конечно же, в таблице Менделеева элементов намного больше. Но в школьном учебнике по химии используется менее половины из них. Дело в том, что в четвёртом периоде таблицы появляются так называемые d-элементы со сложным строением и хитрыми свойствами, о которых школьникам рассказывать не полагается. Да и очень хорошо, нечего голову забивать.
Надеюсь, с понятием «валентность» вы всё-таки разобрались. В следующий раз мы попрактикуемся в определении валентности элементов, если есть формула, и правильном составлении формул веществ, если знаем валентность.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник статьи: http://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/valentnost-eto-prosto-5c57092ca7068000ad582e46
Определяем валентность, зная формулу вещества
Валентность – понятие для химии важное. Напомню, что валентность – это способность атома образовывать химическую связь. А не будь химической связи, как бы существовали молекулы? Но понятие валентности пугает многих школьников, хотя причина этого страха мне не очень понятна. Но всё равно: для тех, кто волнуется , слыша о химии в восьмом классе, вот ещё одно практическое занятие.
Зная валентность атома, мы можем составить формулу вещества . Но учебники химии коварны, они иногда заставляют выполнять обратное задание: определять валентность, если формула вещества имеется. Именно это мы и научимся сейчас делать.
Итак, пример 1.
Известно, что формула углекислого газа – СО2. Нужно понять, какую валентность проявляет здесь углерод. Решается эта нехитрая задачка просто. Для начала давайте-ка вспомним, что кислород всегда имеет валентность II . Значит, смело пишем:
Пока мы указали валентность , уже известную, написав над кислородом II. Но вы же помните, что валентность II означает, что атом может образовать две связи? Теперь внимание! Один атом кислорода может образовать две связи (потому что его валентность II) . Но в нашей формуле два атома кислорода. Каждый образует две связи, верно? Следовательно, два атома кислорода могут образовать всего четыре связи.
Чтобы было нагляднее, представьте себе человека с именем Кислород. Сколько у него рук? Две. Вы будете называться в нашей игре Углерод. Вот Кислород двумя руками за вас и схватился (образовал две связи с вами, так сказать). В нашей компании (то есть формуле углекислого газа) два человека (или атома) кислорода. Это значит, что к вам, Углероду, прицепился и ещё один человек с именем Кислород, и тоже двумя руками. Вопрос: сколько рук за вас сейчас держатся? Ответ: четыре (каждый прилипчивый Кислород ухватил вас, Углерод, двумя руками).
И что же мы вертимся вокруг цифры 4? Так это и есть валентность углерода, ведь вы, будучи Углеродом, позволили, чтобы к вам прицепились четыре руки (по две от каждого Кислорода). Следовательно:
Ответ на задачу: атом углерода имеет валентность IV в молекуле углекислого газа.
Здесь ещё дарю лайфхак. Чтобы определить валентность атома быстрее, не воображая себя химическим элементом, поступаем так. Нужно умножить валентность первого атома на индекс (индекс – маленькая циферка, стоящая справа внизу возле элемента), а валентность второго атома на его индекс. Произведения должны быть равны!
Поясню. Валентность углерода мы как раз хотим узнать, поэтому не мудрим и обозначаем её Х. Значит, для углерода произведение «валентность*индекс» = Х*1 (1 – индекс, просто обычно единица в формуле не пишется). Для кислорода «валентность*индекс» = 2*2 (валентность II, индекс 2). Произведения должны быть равны, значит:
Находим Х. Ура, это снова 4!
Пример 2.
Этот случай разберём менее подробно, он похож на предыдущий. Итак, у нас имеется некий оксид серы SO3. Хочется знать, какова здесь валентность серы. Не колеблясь пишем:
Используем лайфхак и составляем произведения «валентность*индекс». Для серы получаем Х*1 (потому что в формуле один атом серы). Для кислорода получаем 2*3 (2-валентность кислорода, 3 – индекс). Составляем равенство:
Отсюда Х=6. Вы удивитесь, но это и есть правильный ответ: SO3 – это формула оксида серы (VI). Сера здесь имеет валентность VI.
Пример 3.
Вас решил запутать репетитор по химии и задал задачку посложнее. Оксид азота имеет формулу N2O5. Какова валентность азота? Но, я уверена, сейчас вы с лёгкостью ответите на вопрос. Потому что:
Для азота произведение «валентность*индекс» такое: Х*2 (индекс возле азота — 2).
Для кислорода произведение «валентность*индекс» такое: 2*5 (валентность кислорода 2, индекс у атома кислорода – 5).
И Х=5. Да-да-да, всё верно, валентность азота в данном оксиде V!
Надеюсь, вам пригодится этот простой способ определения валентности и больше задания на эту тему вас пугать не будут.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник статьи: http://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/opredeliaem-valentnost-znaia-formulu-vescestva-5c598933c3fe9900ac0421da