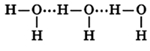Вода. Что эта такое?
Что такое вода? Этот вопрос может показаться странным. Посудомоечная или стиральная машина, счётчики воды, фильтр для воды, бутилированная минеральная вода – слово « вода » для нас такое же привычное, как слово «воздух». Конечно, без воды человек проживёт куда больше, чем без воздуха, но всё равно эта жизнь не будет длинной. Из сложных веществ именно
вода – самое распространённое вещество на Земле,
поэтому всё-таки стоит узнать о воде чуть больше.
Что такое вода
Итак, вода – сложное химическое соединение, состоящее из водорода и кислорода . Формула воды Н2О, с точки зрения строения вещества молекула воды выглядит так:
(красный атом – это кислород, два белых – атомы водорода).
А теперь я открою небольшой секрет.
Жидкость, которую мы обычно называем водой, на самом деле является раствором.
То есть это вода, в которой растворены различные вещества . Речная, морская, водопроводная вода – в реальности это настоящие растворы, поскольку в них присутствуют соли . Действительно чистая вода без примесей называется дистиллированной , в ней практически нет солей и газообразных примесей. Дистиллированную воду можно купить в аптеке или сделать самостоятельно, постепенно замораживая водопроводную воду.
Чистая вода без примесей является эталонной жидкостью, ведь именно воду использовал шведский учёный Андерс Цельсий для создания температурной шкалы. Впоследствии её модифицировал швед Карл Линней, превратив в ту самую систему измерения температур, которой мы пользуемся по сей день. Согласно ей 0 градусов Цельсия – температура плавления льда и перехода его из твёрдого состояния в жидкое (при нормальном давлении в 1 атмосферу или 1013 25 Па), а 100 градусов Цельсия – температура перехода воды из жидкого состояния в газообразное, то есть кипения .
Также отметим, что за эталон берётся и плотность воды (при нормальных условиях) – 1 г/см3. Плотности остальных веществ соотносятся именно с этой величиной.
Дистиллированная вода в обычных условиях – жидкость без цвета и запаха, не имеющая цвета. Возможно, вы замечали, что вода, текущая из водопровода или морская имеют цвет, легкий аромат или привкус. Всё это – следствие того, что в воде растворены вещества, которые и придают воде цветовые, ароматические и вкусовые оттенки.
Как получают воду
В лабораторных условиях воду получают путём сжигания водорода в кислороде , при это протекает реакция:
Также можно получить воду путём сжигания различных органических соединений, например, при сжигании метана CН4 получается углекислый газ и вода:
СН4 + 2О2 = СО2 + 2Н2О.
При сжигании этилового спирта (этанола) также образуется углекислый газ и вода:
С2Н5ОН +3О2 = 2СО2 + 3Н2О
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник статьи: http://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/voda-chto-eta-takoe-5c8291bbd2350300b47ccc1a
Вода (H2O)
Оксид водорода (H2O), гораздо более известный всем нам под названием «вода», без преувеличения, является главной жидкостью в жизнедеятельности организмов на Земле, ибо все химико-билогические реакции проходят, либо с участием воды, либо в растворах.
Вода является вторым, после воздуха, самым важным веществом для организма человека. Прожить без воды человек может не более 7-8 суток.
Чистая вода в природе может существовать в трех агрегатных состояниях: в твердом — в виде льда, в жикдом, собственно вода, в газообразном — в виде пара. Таким разнообразием агрегатных состояний в природе больше не может похвастаться ни одно вещество.
Физические свойства воды
- при н.у. — это жидкость без цвета, запаха и вкуса;
- вода обладает высокой теплоёмкостью и низкой электропроводностью;
- температура плавления 0°C;
- температура кипения 100°C;
- максимальная плотность воды при 4°C равна 1 г/см 3 ;
- вода — хороший растворитель.
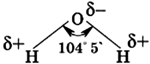
Строение молекулы воды
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода — положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры — чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии — образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химические свойства воды
Вода «охотно» вступает в реакции с другими веществами:
- с щелочными и щелочноземельными металлами вода реагирует при н.у.:
- с менее активными металлами и неметаллами вода реагирует только при высокой температуре:
- с основными оксидами при н.у. вода реагирует с образованием оснований:
- с кислотными оксидами при н.у. вода реагирует с образованием кислот:
- вода является главным участником реакций гидролиза (подробнее см. Гидролиз солей);
- вода участвует в реакциях гидратации, присоединяясь к органическим веществам с двойными и тройными связями.
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник статьи: http://prosto-o-slognom.ru/chimia/501_voda_H2O.html
Вода как химическое соединение
Заканчиваем цикл статей, посвященных соединениям 
Вода — неорганическое соединение, оксид водорода или гидрид кислорода. Вода составляет всего 0,05% массы планеты, но покрывает, в виде жидкости и льда, более 70% ее поверхности.
Кроме обычной воды, существует такая же внешне, но отличная по свойствам тяжелая вода, с дейтерием в молекуле, и сверхтяжелая вода с изотопом тритием. Тяжелая вода плохо растворяет соли, скорость химических реакций в ней другая. Она не поддерживает биологические процессы в живых клетках и не утоляет жажду. Ее еще называют «мертвой водой». Она востребована в атомной энергетике.
Свойства
Прозрачная жидкость, без цвета (в тонком слое), без запаха и вкуса. По своим физическим свойствам представляет собой аномальное вещество. В нормальных условиях вода жидкая, а похожие по составу водородные соединения (метан, фтороводород, сероводород) — газы. Если сравнить воду с гидридами серы, теллура и селена, относящимися к той же группе таблицы Менделеева, что и кислород, то выясняется, что кипит и замерзает вода «неправильно». По правилам, она должна была бы кипеть при -80 °С, а замерзать при -100 °С, а не кипеть при +100 и замерзать при 0 °С.

Вода — очень сильный растворитель. Пропускает УФ-излучение, поглощает инфракрасное и микроволновое излучение. Чистая вода не пропускает электрический ток, но так как в «обычной» воде всегда растворены какие-то вещества, то, на практике, вода хорошо пропускает электричество. На этом свойстве основан принцип действия ионометров, определяющих чистоту воды по ее электропроводности.
Аномальные свойства воды ученые объясняют ее сложным изотопным составом и водородными связями между молекулами. У водорода имеется 5 изотопов, у кислорода — шесть. Всего возможно 23 комбинации изотопного состава воды, из них в природной воде найдены 9.
Вода относится к химически активным веществам, 
Важнейшее свойство воды — ее возможность распадаться на ионы. Ионы воды, присоединяясь к молекулам погруженного в воду вещества, ослабляют связи между его молекулами, способствуя его растворению.
Источник статьи: http://pcgroup.ru/blog/voda-kak-himicheskoe-soedinenie/