Формула угольной кислоты
Определение и формула угольной кислоты
Угольная кислота в свободном виде не выделена. Она существует в разбавленном растворе при комнатной температуре в виде гидрата состава CO2×H2O, который также частично изомеризуется в H2CO3 (молекулы H2CO3 обнаружены также в газовой фазе).
Химическая формула угольной кислоты
Химическая формула угольной кислоты – H2CO3. Она показывает, что в составе молекулы этого сложного вещества находится два атома водорода (Ar = 1 а.е.м.), один атом углерода (Ar = 12 а.е.м.)и три атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу перманганата калия:
Mr(H2CO3) = 2×1 + 12 + 3×16 = 2 + 12 + 48 = 62
Структурная (графическая) формула угольной кислоты
Более наглядной является структурная (графическая) формула угольной кислоты. Она показывает то, как связаны атомы между собой внутри молекулы. Структурная формула угольной кислоты имеет вид:
Угольная кислота способна диссоциировать на ионы в водном растворе согласно следующему уравнению:
В этой связи для угольной кислоты также можно указать и ионную формулу:
Электронные формулы
Электронные формулы, показывающие распределение электронов в атоме по энергетическим подуровням принято изображать только для отдельных химических элементов, однако для угольной кислоты можно представить и такую формулу (рис. 1.).
Рис. 1. Электронная формула угольной кислоты.
Примеры решения задач
| Задание | Установите массовую формулу вещества, содержащего 40,0% кальция, 12,0% углерода и 48,0% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим количество моль элементов, входящих в состав соединения за «х» (кальций), «у» (углерод) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(Ca)/Ar(Ca) : ω(C)/Ar(C) : ω(O)/Ar(O);
Значит формула соединения кальция, углерода и кислорода будет иметь вид CaCO3. Это карбонат кальция.
| Задание | Установите массовую формулу вещества, содержащего 26,5% калия, 35,4% хрома и 38,1% кислорода. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (хром) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(Cr)/Ar(Cr) : ω(O)/Ar(O);
Значит формула соединения калия, хрома и кислорода будет иметь вид KCrO4. Это хромат калия.
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ugolnoj-kisloty/
Как пишется угольная кислота в химии
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:

Скорость прямой реакции 0,039 с −1 , обратной — 23 с −1 .
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:

Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции

Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение pH в такой системе, соответствующей насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:

Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе 
Взаимодействие с основаниями и солями
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:




При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:

Получение
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:

Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. Газированная вода).
В биохимии используется свойство равновесной системы 
Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот [3] .
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
См. также
Примечания
- ↑ 123 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑Угольная кислота теперь обнаружена и в газовой фазе — пора снова переписывать учебники
- ↑Нейланд О. Я. Органическая химия. — М .: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1
Литература
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М .: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М .: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | — | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | — | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
 Оксиды углерода Оксиды углерода | ||
|---|---|---|
| Оксиды | CO2 · CO | 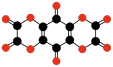 |
| Экзотические оксиды | Карбонилы металлов · Угольная кислота · Гидрокарбонаты · Карбонаты · Дикарбонаты · Трикарбонаты | |
Wikimedia Foundation . 2010 .
Смотреть что такое «Угольная кислота» в других словарях:
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Дает соли карбонаты и гидрокарбонаты … Большой Энциклопедический словарь
УГОЛЬНАЯ КИСЛОТА — (H2CO3) очень слабая и непрочная двухосновная кислота, образующаяся при растворении в воде диоксида углерода (углекислого газа) CO2. Дает 2 ряда солей: карбонаты и бикарбонаты (гидрокарбонаты). В природе широко распространены нормальные карбонаты … Российская энциклопедия по охране труда
Угольная кислота — УГОЛЬНАЯ КИСЛОТА, H2CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид). … Иллюстрированный энциклопедический словарь
угольная кислота — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты. * * * УГОЛЬНАЯ КИСЛОТА УГОЛЬНАЯ КИСЛОТА, Н2СО3, очень слабая и непрочная двухосновная кислота.… … Энциклопедический словарь
Угольная кислота — H2CO3, слабая двухосновная кислота, при нормальных условиях существующая только в разбавленных водных растворах. У. к. образуется при растворении в воде двуокиси углерода: 2, при нормальных условиях не превышает 1% от содержания CO2.… … Большая советская энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3, очень слабая и непрочная двухосновная кислота. Образуется при растворении диоксида углерода в воде. Даёт соли карбонаты и гидрокарбонаты … Естествознание. Энциклопедический словарь
Угольная кислота — (медико санит.) см. Углерод … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
УГОЛЬНАЯ КИСЛОТА — H2CO3, образуется при растворении CO2 в воде. Проявляет св ва слабой к ты. Равновесие CO2+H2O H2CO3 смещено влево, поэтому меньшая часть CO2 находится в р ре в виде H2CO3. Для У. к. константы диссоциации K1=4,27 … Химическая энциклопедия
УГОЛЬНАЯ КИСЛОТА — Н2СО3 очень слабая к та, существующая только в водном р ре. У. к. образуется при растворении углерода диоксида в воде (H2О + CO2 H2CO3). Как двухосновная к та У. к. даёт 2 ряда солей: средние карбонаты и кислые гидрокарбонаты … Большой энциклопедический политехнический словарь
УГОЛЬНАЯ КИСЛОТА, H2CO3 — УГОЛЬНАЯ КИСЛОТА, H2CO3, образуется при растворении углерода диоксида в воде. Важнейшие производные карбонаты, мочевина (карбамид) … Современная энциклопедия
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/72020














