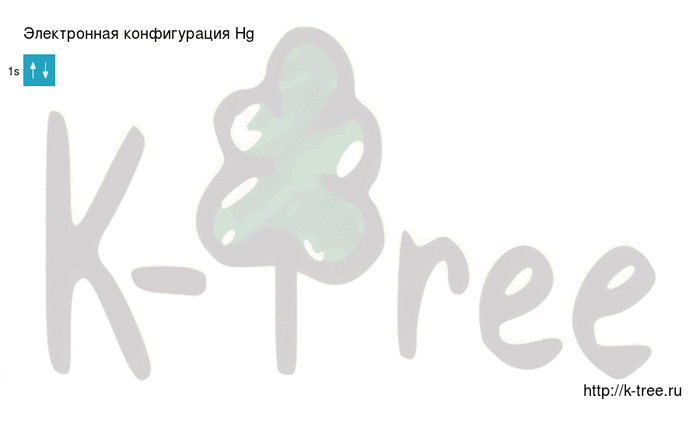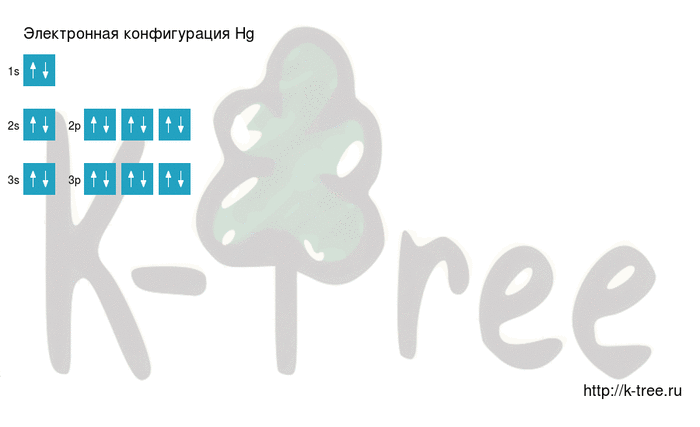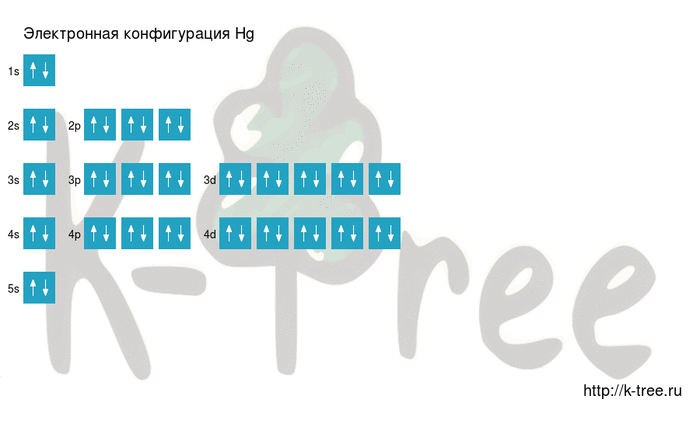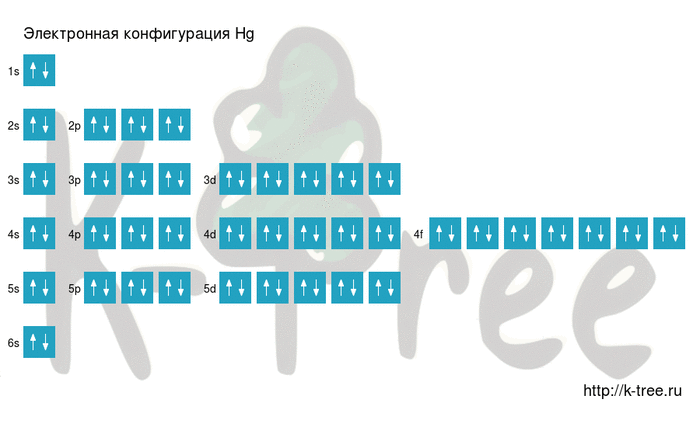Как пишется ртуть в таблице менделеева
Ртуть (лат. hydrargyrum), hg, химический элемент ii группы периодической системы Менделеева, атомный номер 80, атомная масса 200,59; серебристо-белый тяжёлый металл, жидкий при комнатной температуре. В природе Р. представлена семью стабильными изотопами с массовыми числами: 196 (0,2%), 198 (10,0%), 199 (16,8%), 200 (23,1%), 201 (13,2%), 202 (29,8%), 204 (6,9%).
Историческая справка. Самородная Р. была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая. Ими же, а также греками и римлянами применялась киноварь (природная hgs) как краска, лекарственное и косметическое средство. Греческий врач Диоскорид (1 в. н. э.), нагревая киноварь в железном сосуде с крышкой, получил Р. в виде паров, которые конденсировались на холодной внутренней поверхности крышки. Продукт реакции был назван hydr a rgyros (от греч. h y dor — вода и a rgyros — серебро), т. е. жидким серебром, откуда произошли латинские названия hydrargyrum, а также argentum vivum — живое серебро. Последнее сохранилось в названиях p. quicksilver (англ.) и quecksilber (нем.). Происхождение русского названия Р. не установлено. Алхимики считали Р. главной составной частью всех металлов. «Фиксация» Р. (переход в твёрдое состояние) признавалась первым условием её превращения в золото. Твёрдую Р. впервые получили в декабре 1759 петербургские академик И. А. Браун и М. В. Ломоносов. Учёным удалось заморозить Р. в смеси из снега и концентрированной азотной кислоты. В опытах Ломоносова отвердевшая Р. оказалась ковкой, как свинец. Известие о «фиксации» Р. произвело сенсацию в учёном мире того времени; оно явилось одним из наиболее убедительных доказательств того, что Р. — такой же металл, как и все прочие.
Распространение Р. в природе. Р. принадлежит к числу весьма редких элементов, её среднее содержание в земной коре (кларк) близко к 4,5 ? 10 -6 % по массе. Приблизительно в таких количествах она содержится в изверженных горных породах. Важную роль в геохимии Р. играет её миграция в газообразном состоянии и в водных растворах. В земной коре Р. преимущественно рассеяна; осаждается из горячих подземных вод, образуя ртутные руды (содержание Р. в них составляет несколько процентов). Известно 35 ртутных минералов; главнейший из них — киноварь hgs.
В биосфере Р. в основном рассеивается и лишь в незначительных количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4 ? 10 -5 %). В морской воде содержится 3 ? 10 -9 % Р.
Самородная Р., встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путём (выделяется из водных растворов).
Физические и химические свойства Р. — единственный металл, жидкий при комнатной температуре. Твёрдая Р. кристаллизуется в ромбические сингонии, а = 3,463 å, с = 6,706 å; плотность твёрдой Р. 14,193 г/см 3 (—38,9 °С), жидкой 13,52 г/см 3 (20 °С), атомный радиус 1,57 å, ионный радиус hg 2+ 1,10 å; t пл — 38,89 °С; t kип 357,25 °С; удельная теплоемкость при 0 °С 0,139 кдж/ ( кг ? К) [0,03336 кал/ ( г ? °С)]; при 200 °С 0,133 кдж/ ( кг ? К)[0,0319 кал/(г ? °С)]; температурный коэффициент линейного расширения 1,826 ? 10 -4 (0—100 °С); теплопроводность 8,247 вт /( м ? К) [0,0197 кал/ ( см ? сек ? °c) (при 20°c); удельное электросопротивление при 0°С 94,07 ? 10 -8 ом ? м (94,07 ? 10 -6 ом ? см ) . При 4,155 К Р. становится сверхпроводником. Р. диамагнитна, её атомная магнитная восприимчивость равна —0,19 ? 10 -6 (при 18 °С).
Конфигурация внешних электронов атома hg 5d 10 6s 2 , в соответствии с чем при химических реакциях образуются катионы hg 2+ и hg 2 2+ . Химическая активность Р. невелика. В сухом воздухе (или кислороде) она при комнатной температуре сохраняет свой блеск неограниченно долго. С кислородом даёт 2 соединения: чёрную закись hg 2 o и красную окись hgo. hg 2 o появляется в виде чёрной плёнки на поверхности Р. при действии озона. hgo образуется при нагревании hg на воздухе (300—350 °С), а также при осторожном нагревании нитратов hg (no 3 ) 2 или hg 2 (no 3 ) 2 . Гидроокись Р. практически не образуется. При взаимодействии с металлами, которые Р. смачивает, образуются амальгамы . Из сернистых соединений важнейшим является hgs, которую получают растиранием hg с серным цветом при комнатной температуре, а также осаждением растворов солей hg 2+ сероводородом или сульфидом щелочного металла. С галогенами (хлором, иодом) Р. соединяется при нагревании, образуя почти недиссоциирующие, в большинстве ядовитые соединения типа hgx 2 . В соляной и разбавленной серной кислотах Р. не растворяется но растворима в царской водке, азотной и горячей концентрированной серной кислотах.
Почти все соли hg 2+ плохо растворимы в воде. К хорошо растворимым относится нитрат hg (no 3 ) 2 .
Большое значение имеют хлориды Р.: hg 2 cl 2 ( каломель ) и hgcl 2 ( сулема ) Известны соли окисной Р. цианистой и роданистой кислот, а также ртутная соль гремучей кислоты hg (onc) 2 , т. н. гремучая ртуть . При действии аммиака на соли образуются многочисленные комплексные соединения , например hgci ? 2nh 3 (плавкий белый преципитат) и hgnh 2 ci (неплавкий белый преципитат). Применение находят ртутьорганические соединения .
Получение Р. Ртутные руды (или рудные концентраты), содержащие Р. в виде киновари, подвергают окислительному обжигу
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая Р. стекает в железные приёмники. Для очистки сырую Р. пропускают тонкой струйкой через высокий (1—1,5 м ) сосуд с 10%-ной hno 3 , промывают водой, высушивают и перегоняют в вакууме.
Возможно также гидрометаллургическое извлечение Р. из руд и концентратов растворением hgs в сернистом натрии с последующим вытеснением Р. алюминием. Разработаны способы извлечения Р. электролизом сульфидных растворов.
Применение. Р. широко применяется при изготовлении научных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы , полярографы, капиллярные электрометры и др.), в ртутных лампах , переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации золота и серебра, при изготовлении взрывчатых веществ; в медицине (каломель, сулема, ртутьорганические и другие соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения Р.) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). Р. и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
Р. в организме. Содержание Р. в организмах составляет около 10 -6 % В среднем в организм человека с пищей ежесуточно поступает 0,02—0,05 мг Р. Концентрация Р. в крови человека составляет в среднем 0,023 мкг/мл, в моче — 0,1—0,2 мкг/мл. В связи с загрязнением воды промышленными отходами в теле многих ракообразных и рыб концентрация Р. (главным образом в виде её органических соединений) может значительно превышать допустимый санитарно-гигиенический уровень. Ионы Р. и её соединения, связываясь с сульфгидрильными группами ферментов, могут инактивировать их. Попадая в организм, Р. влияет на поглощение и обмен микроэлементов — cu, zn, cd, se. В целом биологическая роль Р. в организме изучена недостаточно.
Отравления Р. и её соединениями возможны на ртутных рудниках и заводах, при производстве некоторых измерительных приборов, ламп, фармацевтических препаратов, инсектофунгицидов и др.
Основную опасность представляют пары металлической Р., выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании Р. попадает в кровь. В организме Р. циркулирует в крови, соединяясь с белками; частично откладывается в печени, в почках, селезёнке, ткани мозга и др. Токсическое действие связано с блокированием сульфгидрильных групп тканевых белков, нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма Р. выводится через почки, кишечник, потовые железы и др.
Острые отравления Р. и её парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. Характерный признак отравления — появление по краю дёсен каймы сине-чёрного цвета; поражение дёсен (разрыхлённость, кровоточивость) может привести к гингивиту и стоматиту. При отравлениях органическими соединениями Р. (диэтилмеркурфосфатом, диэтил-ртутью, этилмеркурхлоридом) преобладают признаки одновременного поражения центральной нервной (энцефало-полиневрит) и сердечно-сосудистой систем, желудка, печени, почек.
Лечение: внутривенное введение 20%-ного раствора гипосульфита (12—15 вливаний на курс), унитиол, фармакологические и физиотерапевтические средства, нормализующие высшую нервную деятельность, курортолечение (Пятигорск, Мацеста и т. п.) и др. Профилактика: замена Р. менее вредными веществами, правильные способы хранения, соблюдение мер безопасности при использовании (герметичность оборудования, рациональная отделка помещений, рабочих поверхностей, эффективная вентиляция), индивидуальная защита; предварительные и периодические медицинские осмотры.
Препараты Р. находят применение в медицинской практике, главным образом благодаря их антисептическим и мочегонным свойствам. Как мочегонные применяют меркузал, промеран и др. В качестве антисептиков используют сулему (дезинфекция кожи, одежды, предметов ухода за больными и т. п.), диоцид (стерилизация хирургических инструментов и т. п.), цианид и оксицианид Р. (для промываний и спринцеваний при некоторых воспалительных процессах), амидохлорид Р. (в виде мази при заболеваниях кожи), окись Р. жёлтую (в виде мази при заболеваниях глаз и кожи). Применявшиеся ранее для лечения сифилиса препараты Р. в современной практике не используются.
Лит.: Мельников С. М., Ртуть, в кн.: Краткая химическая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966; Рипан Р., Четяну И., Неорганическая химия, пер. с рум., М., 1972; Некрасов Б. В., Основы общей химии, 2 изд., т. 2, М., 1969; Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., [ч. 2], Л., 1971; Трахтенберг И. М., Хроническое воздействие ртути на организм, К., 1969; Профессиональные болезни, 3 изд., М., 1973.
Источник статьи: http://www.h2o.u-sonic.ru/table/hg.htm
Ртуть Hg
Ртуть в таблице менделеева занимает 80 место, в 6 периоде.
| Символ | Hg |
| Номер | 80 |
| Атомный вес | 200.5920000 |
| Латинское название | Hydrargyrum |
| Русское название | Ртуть |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема ртути
Hg: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10
Короткая запись:
Hg: [Xe]6s 2 4f 14 5d 10
Одинаковую электронную конфигурацию имеют атом ртути и Tl +1 , Pb +2 , Bi +3 , Po +4 , At +5
Порядок заполнения оболочек атома ртути (Hg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Ртуть имеет 80 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
Степень окисления ртути
Атомы ртути в соединениях имеют степени окисления 2, 1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы ртути
Валентность Hg
Атомы ртути в соединениях проявляют валентность II, I.
Валентность ртути характеризует способность атома Hg к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Hg
Квантовые числа определяются последним электроном в конфигурации, для атома Hg эти числа имеют значение N = 5, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник статьи: http://k-tree.ru/tools/chemistry/periodic.php?element=Hg
Введение
Ртуть ( Hg , от лат. Hydrargyrum ) – элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка (побочной подгруппе II группы). Простое вещество ртуть – переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть – один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент – бром).
История
Ртуть известна с древних времен. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твердость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 г. Для представления элемента как у алхимиков, так и в нынешнее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства: ковкость, электропроводность и др.
Ртуть – вещество первого класса опасности. Является переходным металлом, представляющим собой серебристо-белую жидкость с тяжелой массой, пары которой очень ядовиты (в условиях привычной температуры жилых помещений).
Ртуть Hg , химический элемент II группы периодичной системы, атомное число 80, атомная масса 200,59. Природная ртуть состоит из семи стабильных изотопов: 196 Hg (0,146%), 198 Hg (10,02%), 199 Hg (16,84%), 200 Hg (23,13%), 201 Hg (13,22%), 202 Hg (29,80%), 204 Hg (6,85%). Поперечное сечение захвата тепловых нейтронов для природной смеси изотопов 38·10-27м2. Конфигурация внешних электронных оболочек атома 5 s 25 p 65 d 106 s 2; степень окисления + 1 и + 2; энергии ионизации Hg 0: Hg +: Hg 2+: Hg 3+ соответственно 10,4376, 18,756 и 34,2 эВ; сродство к электрону – 0,19 эВ; работа выхода электрона 4,52 эВ; электроотрицательность по Полингу 1,9; атомный радиус 0,155 нм, ковалентный радиус 0,149 нм, ионный радиус (в скобках указано координационное число) Hg + 0,111 нм (3), 0,133 нм (6), Hg 2+ 0,083 нм (2), 0,110 нм (4), 0,116 нм (6), 0,128нм (8).
Химические свойства
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg 22+ со связью металл-металл. Ртуть – один из немногих металлов, способных формировать такие катионы, и у ртути они – самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании и под щ елачивании.
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути ( I ) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути ( II ) со ртутью получается нитрат ртути ( I ).
В степени окисления +2 ртуть образует катионы Hg 2+ , которые очень легко гидролизуются. При этом гидроксид ртути Hg ( OH )2 существует только в очень разбавленных ( −4 моль/л) растворах. В более концентрированных растворах он дегидратируется
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов II Б группы именно у ртути появляется возможность разрушения очень устойчивой 6 d 10 – электронной оболочки, что приводит к возможности существования соединений ртути( IV ), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4К получен HgF 4.
Физические свойства
Ртуть – единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (-38,83 °C),кипит при 629,88 K (356,73 °C), критическая точка –1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы – амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co .
Плотность ртути при нормальных условиях – 13 500 кг/м3.
Таблица 1 – Зависимость плотности от температуры
Простое вещество ртуть ( CAS -номер: 7439-97-6) – переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Ртуть – один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй элемент – бром).
Получение
Ртуть получают путём восстановления из её наиболее распространённого минерала – киновари.
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия вовладениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмдена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов ( VI – IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Нахождение в природе
Ртуть – относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе – рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути – 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути – тиманит ( HgSe ) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В поверхностных условиях киноварь и металлическая ртуть не растворимы в воде, но при их наличии ( Fe 2( SO 4)3, озон, пероксид водорода) растворимость этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах едких щелочей с образованием, например, комплекса HgS • nNa 2 S . Ртуть легко сорбируется глинами, гидроокислами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg ). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда – шватцит (до 17 % Hg ). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb 4 S 7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg 2 Cl 2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения – терлингуаит Hg 2 ClO , эглестонит Hg 4 Cl .
Применение ртути и её соединений
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1970-х годов соединения ртути использовались в медицине очень активно:
● хлорид ртути ( I ) (каломель) – слабительное;
● меркузал и промеран – сильные мочегонные;
● хлорид ртути ( II ), цианид ртути ( II ), амидохлорид ртути и жёлтый оксид ртути( II ) – антисептики (в том числе в составе мазей).
Известны случаи, когда при завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части.
Амальгаму серебра применяли в стоматологии в качестве материала зубных пломб до появления светоотверждаемых материалов.
Ртуть-203 ( T 1/2 = 53 сек) используется в радиофармакологии.
Техника
● Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
● Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жесткого ультрафиолета (254 нм), в каковом качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
● Ртутные электрические вентили (игнитроны) в мощных выпрямительных устройствах, электроприводах, электросварочных устройствах, тяговых и выпрямительных подстанциях и т. п. [18] со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
● Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
● Ртуть используется в датчиках положения.
● В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный элемент Вестона).
● Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
● Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
● Иодид ртути( I ) используется как полупроводниковый детектор радиоактивного излучения.
● Фульминат ртути( II ) («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
● Бромид ртути( I ) применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
● Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
● До середины 20 века ртуть широко применялась в барометрах и манометрах.
● Ртутные вакуумные насосы были основными источниками вакуума в 19 и начале 20 веков.
● Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
● Соединения ртути использовались в шляпном производстве для выделки фетра.
Металлургия
● Металлическая ртуть применяется для получения целого ряда важнейших сплавов.
● Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
● Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов используют электролиз с диафрагмой.
● Ртуть используется для переработки вторичного алюминия (см. амальгамация)
● Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
Химическая промышленность
● Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
● Реактив Несслера используется для количественного определения аммиака.
Сельское хозяйство
Высокотоксичные соединения ртути – каломель, сулему, мертиолят и другие – используют для протравливания семенного зерна и в качестве пестицидов.
Заключение
Запрет использования ртутьсодержащей продукции
С 2020 года международная конвенция, названная в честь массового отравления ртутью и подписанная многими странами, запретит производство, экспорт и импорт нескольких различных видов ртутьсодержащих продукции применяемой в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давлении. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента.
Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl 3.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью и её парами:
● ПДК в населённых пунктах (среднесуточная) – 0,0003 мг / м³
● ПДК в жилых помещениях (среднесуточная) – 0,0003 мг/м³
● ПДК воздуха в рабочей зоне (макс. разовая) – 0,01 мг/м³
● ПДК воздуха в рабочей зоне (среднесменная) – 0,005 мг/м³
● ПДК сточных вод (для неорганических соединений в пересчёте на двухвалентную ртуть) – 0,005 мг/ л
● ПДК водных объектов хозяйственно-питьевого и культурного водопользования, в воде водоёмов – 0,0005 мг/л
Источник статьи: http://www.sites.google.com/a/soe.uspi.ru/tabl-mendeleva/home/rtut