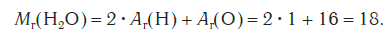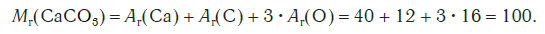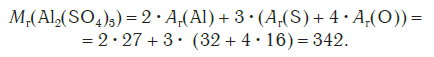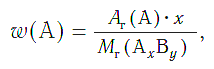Урок 7. Относительная молекулярная и относительная формульная массы
В уроке 7 «Относительная молекулярная и относительная формульная массы» из курса «Химия для чайников» научимся вычислять относительную молекулярную массу, а также относительную формульную массу веществ; кроме того, выясним что такое массовая доля и приведем формулу для ее вычисления. Напоминаю, что в прошлом уроке «Валентность» мы дадим определение валентности, научились ее определять; рассмотрели элементы с постоянной и переменной валентностью, кроме того научились составлять химические формулы по валентности.
Каждый химический элемент характеризуется определенным значением относительной атомной массы. Состав любого вещества выражается молекулярной или простейшей формулой его структурной единицы. Такая структурная единица состоит из определенного числа атомов химических элементов. Поэтому масса структурной единицы может быть выражена в атомных единицах массы.
Относительная молекулярная масса
Вещества молекулярного строения характеризуются величиной относительной молекулярной массы, которая обозначается Mr .
Относительная молекулярная масса — это физическая величина, равная отношению массы одной молекулы вещества к 1/12 части массы атома углерода.
Эта величина равна сумме относительных атомных масс всех химических элементов с учетом числа их атомов в молекуле. Например, рассчитаем относительную молекулярную массу воды H2O:
Относительная молекулярная масса серной кислоты H2SO4:
Относительные молекулярные массы, как и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы u . Например, если Mr (H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода, т. е. в 18 раз больше атомной единицы массы. Соответственно, масса молекулы H2SO4 в 98 раз больше 1/12 части массы атома углерода.
Относительная формульная масса
Вещества немолекулярного строения также характеризуются подобной величиной, которая называется относительной формульной массой. Как и относительная молекулярная масса, она равна сумме относительных атомных масс всех элементов, входящих в состав структурной единицы таких веществ — формульной единицы, и также обозначается Mr . При этом, конечно, необходимо учитывать индексы у символов атомов.
Например, относительная формульная масса вещества CaCO3 равна:
Относительная формульная масса вещества Al2(SO4)3 равна:
Относительная формульная масса показывает, во сколько раз масса формульной единицы данного вещества больше 1/12 части массы атома углерода, или атомной единицы массы u .
Вычисление массовой доли химического элемента по формуле вещества
По формуле вещества можно рассчитать массовую долю атомов каждого химического элемента, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля ( w ) атомов химического элемента в веществе показывает, какая часть относительной молекулярной (формульной) массы вещества приходится на атомы данного элемента.
Массовая доля атомов элемента А в сложном веществе АxBy рассчитывается по формуле:
где w («дубль-вэ») — массовая доля элемента А ;
Ar(А) — относительная атомная масса элемента А ;
х, у — числа атомов элементов А и В в формуле вещества;
Mr(АхBy) — относительная молекулярная (формульная) масса вещества АхBy .
Массовые доли выражаются в долях единицы или в процентах.
Пример. Определите массовые доли элементов в фосфорной кислоте H3PO4
Краткие выводы урока:
- Относительная молекулярная (формульная) масса вещества — это физическая величина, равная отношению массы молекулы (формульной единицы) вещества к 1/12 части массы атома углерода.
- Эта величина равна сумме относительных атомных масс химических элементов, входящих в состав молекулы (формульной единицы) данного вещества, с учетом числа атомов каждого элемента.
Надеюсь урок 7 «Относительная молекулярная и относительная формульная массы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-7-otnositelnaja-molekuljarnaja-i-otnositelnaja-formulnaja-massy.html
Что такое относительная малекулярная масса? Как она рассчитывается?
Молекулярная масса, относительная молекулярная масса (устаревшее название — молекулярный вес) — значение массы молекулы, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12C, поэтому атомная масса этого изотопа по определению равна точно 12. Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ) . Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с учётом числа атомов каждого элемента в формульной единице сложного вещества. Атомы и молекулы — частицы чрезвычайно малые, поэтому порции веществ, которые берутся для химических реакций, характеризуются физическими величинами, соответствующими большому числу частиц.
Относительная молекулярная масса вещества показывает отношение массы его молекулы к 1/12 части
массы атома углерода.
Относительная молекулярная масса является безразмерной величиной потому, что атомные массы
элементов, входящих в состав молекулы, также безразмерные величины. Относительная
молекулярная масса обозначается символом М (r) .
Молекулярная масса вещества вычисляется следующим образом. Относительные атомные массы
каждого элемента умножаются на число их атомов, в составе молекулы. Полученные величины
суммируются. Например, вычислим относительную молекулярную массу воды:
М (r)(Н2О) = (2*1) + 16 = 18
А молекулярная масса воды равна:
М (Н2О) = (2*1) а. е. м. + 16 а. е. м. = 18 а. е. м
Химическая формула является важнейшим понятием в химии и выражает химический состав вещества.
Относительная молекулярная масса вычисляется по химической формуле вещества. Относительная
молекулярная масса вещества показывает, во сколько раз масса его больше 1/12 части массы атома
углерода.
Источник статьи: http://otvet.mail.ru/question/35314650
Химические формулы. Относительная молекулярная масса.
Вы уже знаете, что в молекуле воды один атом кислорода связан с двумя атомами водорода. С помощью знаков химических элементов состав воды можно выразить химической формулой Н2О.
ХИМИЧЕСКАЯ ФОРМУЛА — это условная запись состава вещества посредством химических знаков и индексов.
Цифру 2, стоящую в формуле воды справа внизу у знака элемента водорода, называют индексом. Индекс обозначает число атомов элемента, входящих в состав данного вещества.
Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe и т. д. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке 20 формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три.
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
Химическая формула показывает, из атомов каких элементов состоит вещество (т. е. качественный состав вещества) и каково соотношение атомов этих элементов (т. е. количественный состав вещества).
- Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Относительная молекулярная масса М r — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
M r(H2O) = 2Аr(H) + А r(O) = 2 ⋅ 1 + 16 = 18
M r(CO2) = А r(C) + 2 А r(O) = 12 + 2 ⋅ 16 = 44
Какую же информацию о веществе можно получить по его химической формуле? По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.
1. Химическая формула вещества
4. Качественный состав (из каких химических элементов данное вещество состоит)
В состав воды входят химические элементы водород H и кислород O
В состав углекислого газа входят химические элементы углерод С и кислород О
5. Количественный состав (сколько атомов каждого элемента входит в состав молекулы данного вещества и каковы массовые соотношения элементов)
Молекула воды образована двумя атомами водорода Н и одним атомом кислорода О.
Молекула углекислого газа образована одним атомом углерода С и двумя атомами кислорода О.
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы, а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением, в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формулой, а формульной единицей.
В этом случае величина M r должна называться не относительной молекулярной массой, а относительной формульной массой. Но часто по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Источник статьи: http://zen.yandex.ru/media/id/5ea18ca322b6bd32eecb4f38/himicheskie-formuly-otnositelnaia-molekuliarnaia-massa-5eb9781e46a76d4919819f33
Как пишется относительная молекулярная масса
Химическая формула — это условная запись качественного и количественного состава вещества при помощи химических знаков и индексов.
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Числа стоящие перед химическими формулами или химическими знаками называются коэффициентами . Коэффициенты показывают число атомов или молекул определённого вида.
H2 — это одна молекула водорода (аш-два), в её состав входят два атома водорода.
5O2 — это пять молекул кислорода (пять-о-два), в состав одной молекулы входят два атома кислорода.
6Fe — это шесть атомов железа (шесть-феррум).
3H2SO4 — это три молекулы серной кислоты (три-аш-два-эс-о-четыре), в состав одной молекулы серной кислоты входят два атома водорода, один атом серы, четыре атома кислорода.
Относительная молекулярная масса
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12 C.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr(KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
УПРАЖНЕНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
№1. Вычислите относительные молекулярные массы следующих веществ: NaOH, CuCl2, HNO3
№2. Напишите, что обозначают следующие записи, в скобках указаны названия незнакомых веществ:
Источник статьи: http://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no10-otnositelnaa-molekularnaa-massa-himiceskie-formuly
Как пишется относительная молекулярная масса
Урок посвящен изучению правил составления и чтения химических формул веществ. Вы узнаете, какую информацию дает химическая формула вещества и как на основании данных о массовых долях химических элементов составить химическую формулу. Из материалов урока вы узнаете, как и в чем измеряют массы молекул, как определить порции твердых и жидких веществ, имеющие равное число молекул.
I. Химические формулы
Химическая формула — это условная запись качественного и количественного состава вещества при помощи химических знаков и индексов.
Индекс — это цифра в химической формуле, которая ставится внизу после химического знака и обозначает число атомов данного вида.
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Числа стоящие перед химическими формулами или химическими знаками называются коэффициентами. Коэффициенты показывают число атомов или молекул определённого вида.
H2— это одна молекула водорода (аш-два), в её состав входят два атома водорода.
5O2 — это пять молекул кислорода (пять-о-два), в состав одной молекулы входят два атома кислорода.
6Fe — это шесть атомов железа (шесть-феррум).
3H2SO4 — это три молекулы серной кислоты (три-аш-два-эс-о-четыре), в состав одной молекулы серной кислоты входят два атома водорода, один атом серы, четыре атома кислорода.
II. Относительная молекулярная масса
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Посмотрите презентацию: “Вычисление относительной молекулярной массы серной кислоты”:
III. Закрепление
Задание №1. Вычислите относительные молекулярные массы следующих веществ: NaOH, CuCl2, HNO3
Задание №2. Напишите, что обозначают следующие записи, в скобках указаны названия незнакомых веществ:
Источник статьи: http://kardaeva.ru/88-dlya-uchenika/8-klass/113-8klass-1-10