Как пишется оксид бериллия
В природе оксид бериллия встречается в виде минерала бромеллита. [3]
Получают оксид бериллия термическим разложение гидроксида бериллия и некоторых его солей (например, нитрата, основного ацетата, карбоната и др.) при температуре от 500 до 1000°С. Полученный таким образом оксид представляет собой белый аморфный порошок. В виде кристаллов оксид бериллия может быть получен нагреванием до высокой температуры (плавлением) аморфной формы или, например, при кристаллизации из расплавленных карбонатов щелочных металлов. [2] Упругость пара ВеО незначительна, поэтому в отсутствие паров воды это наименее летучий из всех тугоплавких оксидов. Примесь таких оксидов, как MgO, CaO, Al2O3, SiO2, ещё больше понижает летучесть ВеО из-за химического взаимодействия между ними. В присутствии паров воды при 1000—1800°С летучесть оксида бериллия сильно возрастает в связи с образованием газообразного гидроксида бериллия. [2]
Оксид бериллия обладает очень высокой теплопроводностью. При 100° С она составляет 209,3 Вт / (м К), что больше, чем у любых неметаллов и даже у некоторых металлов. [4]
Химические свойства
Реакционная способность оксида бериллия зависит от способа его получения и от степени прокаливания. Повышение температуры при прокаливании ведет к увеличению размера зерен (то есть к уменьшению удельной поверхности), а, следовательно, и к уменьшению химической активности соединения. [2]
Прокаленный при температуре не выше 500°С, оксид бериллия растворяется в водных растворах кислот и щелочей (даже разбавленных), образуя соответствующие соли и гидроксобериллаты. Например: 
Оксид бериллия, прокаленный при температуре от 1200 до 1300°С растворим в растворах концентрированных кислот. Например, прокаленный таким образом ВеО реагирует с горячей концентрированной серной кислотой: 
Прокаливание оксида бериллия при температурах выше 1800° С приводит к практически полной утрате им реакционной способности. После такого прокаливая ВеО растворяется только в концентрированной плавиковой кислоте (с образованием фторида) и в расплавленных щелочах, карбонатах и пиросульфатах щелочных металлов (с образованием бериллатов): [2] [3] 

Выше 1000°С оксид бериллия реагирует с хлором, при этом в присутствии угля данная реакция идет легче и при гораздо меньших температурах (600—800°С): [2] 
При температуре выше 1000°С оксид бериллия ступает в обратимую реакцию гидрохлорирования (понижение температуры системы вызывает обратный процесс разложения образовавшегося хлорида бериллия): [2] 
При нагревании оксид бериллия способен реагировать со многими хлорсодержащими соединениями. В частности уже при 500°С начинается реакция с фосгеном: [2] 
Хлорирование тетрахлорметаном протекает при температуре 450—700°С: [2] 
Гораздо труднее оксид бериллия взаимодействует с бромом, сведений же о взаимодействии ВеО с иодом нет.
Оксид бериллия реагирует далеко не всеми обычно применяемыми восстановителями. В частности, для восстановления бериллия из оксида применимы лишь кальций, магний, титан и уголь (при высокой температуре). Кальций и магний могут быть использованы в качестве восстановителя при температуре ниже 1700°С и атмосферном давлении, титан применим при давлении ниже 0,001 мм рт. ст. и 1400°С: [2] 
В обоих случаях бериллий получается загрязненным, так как технически очень трудно разделить продукты реакции.
Использование угля более предпочтительно, но реакция с ним идет лишь при температурах выше 2000°С:
Оксид бериллия при температурах ниже 800°С устойчив по отношению к расплавленным щелочным металлам (литию, натрию и калию) и почти совсем не реагирует с Ce, Pt, Mo, Th, Ni и Fe; только при 1800° взаимодействует с Ni, Si, Ti, Zr. [2] [5]
Применение
Сочетание высокой теплопроводности и небольшой коэффициент термического расширения позволяют использовать оксид бериллия в качестве термостойкого материала, обладающего значительной химической инертностью.
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/1842569
бериллия оксид
Энциклопедический словарь . 2009 .
Смотреть что такое «бериллия оксид» в других словарях:
БЕРИЛЛИЯ ОКСИД — ВеО, бесцветные кристаллы; tпл 2578 .С. Огнеупорный и химически стойкий материал для специальной керамики, замедлитель и отражатель нейтронов в ядерных реакторах … Большой Энциклопедический словарь
бериллия оксид — berilio oksidas statusas T sritis chemija formulė BeO atitikmenys: angl. beryllia; beryllium oxide rus. бериллия окись; бериллия оксид … Chemijos terminų aiškinamasis žodynas
БЕРИЛЛИЯ ОКСИД — ВеО, бесцв. кристаллы. До 2100 … Химическая энциклопедия
Оксид бериллия — Общие Систематическое наименование Оксид бериллия Традиционные названия Бромеллит Химическая формула BeO Эмпирическая формула BeO Физические свойства … Википедия
бериллия окись — berilio oksidas statusas T sritis chemija formulė BeO atitikmenys: angl. beryllia; beryllium oxide rus. бериллия окись; бериллия оксид … Chemijos terminų aiškinamasis žodynas
Оксид-сульфат титана — Общие Систематическое наименование Оксид сульфат титана Традиционные названия Основной сернокислый титан; оксосульфат титана; сульфат титанила Химическая формула TiOSO4 Физические свойства … Википедия
оксид бериллия — berilio oksidas statusas T sritis radioelektronika atitikmenys: angl. beryllium oxide vok. Berylliumoxid, n rus. оксид бериллия, m pranc. oxyde de béryllium, m … Radioelektronikos terminų žodynas
Фторид бериллия — Общие Систематическое наименование Фторид бериллия Сокращения Бесцветные кристаллы Традиционные названия Фтористый бериллий Химическая формула BeF2 Физи … Википедия
Нитрат бериллия — Общие Систематическое наименование Нитрат бериллия Традиционные названия Азотнокислый бериллий Химическая формула Be(NO3)2 Эмпирическая формула BeN2O6 … Википедия
Гидроксид бериллия — Общие Систематическое наименование Гидроксид бериллия Химическая формула Be(OH)2 Эмпирическая формула Be(OH)2 Физические свойства Состояние … Википедия
Источник статьи: http://dic.academic.ru/dic.nsf/es/8488/%D0%B1%D0%B5%D1%80%D0%B8%D0%BB%D0%BB%D0%B8%D1%8F
Структура, свойства и применение оксида бериллия (BeO)
оксид бериллия (BeO) представляет собой керамический материал, который, помимо своей высокой прочности и удельного электрического сопротивления, обладает высокой теплопроводностью, что делает его частью ядерных реакторов, превосходя даже металлы по этому последнему свойству..
В дополнение к его полезности в качестве синтетического материала, он также может быть найден в природе, хотя это редко. Его управление должно осуществляться с осторожностью, так как оно способно нанести серьезный вред здоровью людей..
В современном мире наблюдалось, как ученые, связанные с технологическими компаниями, проводили исследования для разработки современных материалов для весьма специализированных применений, таких как материалы, которые соответствуют полупроводниковым материалам, и материалы аэрокосмической промышленности..
Результатом этого стало обнаружение веществ, которые благодаря своим чрезвычайно полезным свойствам и высокой долговечности позволили нам продвинуться во времени, что позволило нам поднять нашу технологию на более высокий уровень..
- 1 Химическая структура
- 2 свойства
- 2.1 Электропроводность
- 2.2 Теплопроводность
- 2.3 Оптические свойства
- 2.4 Риски для здоровья
- 3 использования
- 3.1 Электронные приложения
- 3.2 Ядерные применения
- 3.3 Другие приложения
- 4 Ссылки
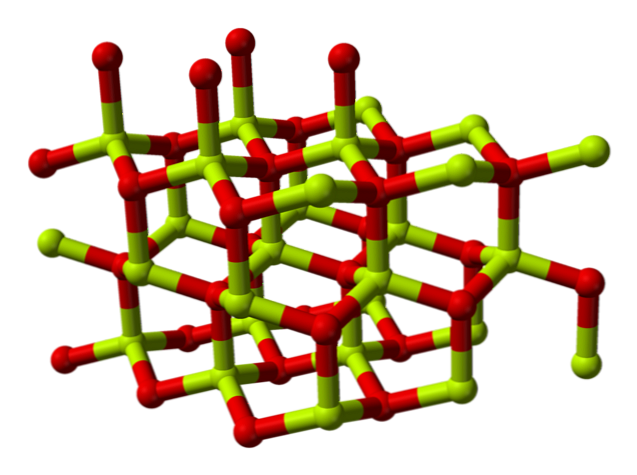
Химическая структура
Молекула оксида бериллия (также называется «Берилли») Он состоит из атома бериллия и атома кислорода, оба координированы в тетраэдрической ориентации, и кристаллизуется в гексагональных кристаллических структурах, называемых вюрцитами..
Эти кристаллы имеют тетраэдрические центры, которые заняты 2+ и O 2- . При высоких температурах структура оксида бериллия становится тетрагональной.
Получение оксида бериллия достигается тремя способами: прокаливанием карбоната бериллия, дегидратацией гидроксида бериллия или воспламенением металлического бериллия. Оксид бериллия, образующийся при высоких температурах, инертен, но может быть растворен несколькими соединениями.
BECO3 + Жара → BeO + CO2 (Обжиг)
Бе (ОН)2 → BeO + H2O (обезвоживание)
2 Be + O2 → 2 BeO (зажигание)
Наконец, оксид бериллия может испаряться, и в этом состоянии он будет представлен в виде двухатомных молекул.
свойства
Оксид бериллия встречается в природе в виде бромеллита, белого минерала, обнаруженного в некоторых сложных месторождениях марганцевого железа, но чаще встречается в его синтетической форме: белого аморфного твердого вещества, которое образуется в виде порошка..
Кроме того, примеси, которые были захвачены в процессе производства, придают оксиду различные цвета..
Его температура плавления составляет 2507 ° С, его температура кипения составляет 3900 ° С, и он имеет плотность 3,01 г / см. 3 .
Точно так же его химическая стабильность значительно высока, он реагирует только с водяным паром при температурах, близких к 1000 ºC, и может противостоять процессам восстановления углерода и воздействиям расплавленных металлов при высоких температурах..
Кроме того, его механическая прочность является достойной и может быть улучшена с помощью конструкций и производства, пригодных для коммерческого использования..
Электропроводность
Оксид бериллия является очень стабильным керамическим материалом и поэтому обладает довольно высоким удельным электрическим сопротивлением, что делает его одним из лучших электроизоляционных материалов наряду с глиноземом..
Из-за этого этот материал обычно используется для специализированного высокочастотного электрического оборудования.
Теплопроводность
Оксид бериллия имеет большое преимущество с точки зрения его теплопроводности: он известен как второй лучший теплопроводящий материал среди неметаллов, уступая только алмазу, материалу, значительно более дорогому и редкому..
Что касается металлов, только медь и серебро передают тепло лучше проводимости, чем оксид бериллия, что делает его очень желательным материалом.
Благодаря своим отличным теплопроводящим свойствам это вещество используется для производства огнеупорных материалов..
Оптические свойства
Из-за своих кристаллических свойств оксид бериллия используется для нанесения прозрачного материала на ультрафиолет в некоторых плоских экранах и фотоэлектрических элементах..
Аналогично, могут быть получены кристаллы очень высокого качества, поэтому эти свойства улучшаются в соответствии с используемым производственным процессом..
Риски для здоровья
Оксид бериллия является соединением, с которым необходимо обращаться с большой осторожностью, поскольку он сначала обладает канцерогенными свойствами, которые связаны с непрерывным вдыханием порошков или паров этого материала..
Мелкие частицы в этих фазах оксида прилипают к легким и могут вызывать образование опухолей или болезнь, известную как бериллиоз..
Бериллиоз — это заболевание со средним уровнем смертности, которое вызывает неэффективное дыхание, кашель, потерю веса и повышение температуры, а также образование гранулем в легких или других пораженных органах..
Существует также опасность для здоровья от прямого контакта оксида бериллия с кожей, так как он вызывает коррозию и раздражение и может привести к повреждению поверхности кожи и слизистых оболочек. При работе с этим материалом необходимо защищать дыхательные пути и руки, особенно в виде порошка..
приложений
Использование оксида бериллия в основном делится на три: электронное, ядерное и другие применения.
Электронные приложения
Способность передавать тепло на высокий уровень и его хорошее удельное электрическое сопротивление сделали оксид бериллия приобретающим большое применение в качестве теплоотвода..
Его использование было подтверждено в цепях внутри компьютеров большой емкости, в дополнение к оборудованию, которое обрабатывает большие токи электричества..
Оксид бериллия прозрачен для рентгеновских лучей и микроволн, поэтому он используется в окнах против этих видов излучения, а также в антеннах, системах связи и микроволновых печах..
Ядерные применения
Его способность смягчать нейтроны и сохранять свою структуру под воздействием радиации привела к тому, что оксид бериллия участвует в строительстве ядерных реакторов, а также может применяться в высокотемпературных реакторах, охлаждаемых газами..
Другие приложения
Низкая плотность оксида бериллия вызвала интерес в аэрокосмической и военной промышленности, поскольку он может представлять собой вариант с малым весом в ракетных двигателях и бронежилетах.
Наконец, недавно был применен в качестве огнеупорного материала при плавлении металлов в металлургической промышленности.
Источник статьи: http://ru.thpanorama.com/articles/qumica/xido-de-berilio-beo-estructura-propiedades-y-usos.html