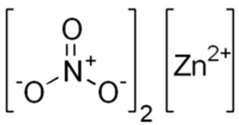Формула нитрата цинка
Определение и формула нитрата цинка
Рис. 1. Нитрат цинка. Внешний вид.
Химическая формула нитрата цинка
Химическая формула нитрата цинка Zn(NO3)2. Она показывает, что в составе молекулы этого вещества находится один атом цинка (Ar = 65 а.е.м.), два атома азота (Ar = 14 а.е.м.) и шесть атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата цинка:
Mr(Zn(NO3)2) = 65 + 2×14 + 6×16 = 65 + 28 + 96 = 189.
Структурная (графическая) формула нитрата цинка
Структурная (графическая) формула нитрата цинка является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Нитрат цинка является электролитом, т.е. в водном растворе диссоциирует на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [14,8 / 44]×12 = 4,04 г;
m(H) = 2×3,6 / 18 ×1= 0,4 г.
Определим химическую формулу углеводорода:
Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 39 = 78 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Msubstance / M(CH) = 78 / 13 = 6.
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол.
| Задание | При полном сгорании на воздухе 7,4 г кислородсодержащего органического соединения образовалось 6,72 л (н.у.) углекислого газа и 5,4 мл воды. Выведите формулу этого соединения. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [6,72 / 22,4]×12 = 3,6 г;
m(H) = [2×5,4 ×1 / 18 ×1 (г/мл)] = 0,6 г.
Определим химическую формулу соединения:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z= 0,3 : 0,6 : 0,2 = 1,5: 3 : 1 = 3 : 6 : 2.
Значит простейшая формула соединения C3H6O2 и молярная масса 64 г/моль
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-nitrata-cinka/
Нитрат цинка
| Нитрат цинка | |
|---|---|
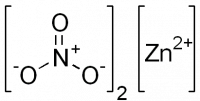 | |
| Систематическое наименование | Нитрат цинка |
| Традиционные названия | Азотнокислый цинк |
| Хим. формула | Zn(NO3)2 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 189,40 г/моль |
| Растворимость | |
| • в воде | 128 25 ; 1250 73 г/100 мл |
| ГОСТ | ГОСТ 5106-77 |
| Рег. номер CAS | 7779-88-6 |
| PubChem | 24518 |
| Рег. номер EINECS | 231-943-8 |
| SMILES | |
| RTECS | ZH4772000 |
| Номер ООН | 1514 |
| ChemSpider | 22926 и 57426206 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Содержание
Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
ZnO + 2HNO3 → Zn(NO3)2 + H2O Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2 H2O ZnCO3 + 2HNO3 → Zn(NO3)2 + CO2↑ + H2O
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
Zn + 2N2O4 → Zn(NO3)2 + 2NO↑
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Источник статьи: http://chem.ru/nitrat-cinka.html
Соли цинка
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Источник статьи: http://chemege.ru/soli-zink/