Нитрат серебра I
| Нитрат серебра | |
|---|---|
 | |
| Систематическое наименование | Нитрат серебра |
| Традиционные названия | Адский камень, ляпис |
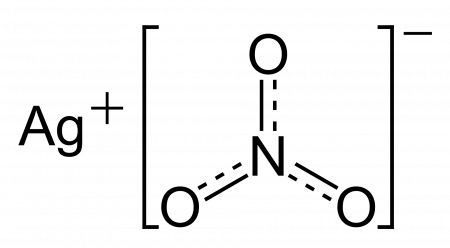
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Температура | |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | −124,4 кДж/моль |
| Растворимость | |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Показатель преломления | 1,744 |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES | |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |     |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Содержание
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O 
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓ 
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Источник статьи: http://chem.ru/nitrat-serebra-i.html
Нитрат серебра
( Ляпис ) основное получение реакцией серебра с азотной кислотой :
Ag + 2HNO3 → AgNO3 + NO2 + H2O
Применение
Применяется в медицине как средство для прижигания свежих ранок и бородавок . Благодаря своим бактерицидным свойствами используется и в настоящее время как противовоспалительное средство.
Реакции нитрата
Нитрат серебра нагревание нитрата натрия свыше 350°C приводит к разложению его на свободный металл , оксид азота и кислород :
Реакция с щелочами приводит к образованию оксида серебра ( I ) и нитрата щёлочи :
2AgNO3 + 2NaOH → Ag2O + 2NaNO3 + H2O
Реакция с солями галогенов приводит к образованию соответствующих ( хлоридов , бромидов , йодидов ) серебра и нитратов щелочей :
Карбонат натрия приводит к образованию карбоната серебра и нитрата серебра :
2AgNO3 + Na2CO3 = Ag2CO3 + 2NaNO3
Реакция с серной кислотой ( конц. ) приводит к образованию сульфата серебра и азотной кислоты :
2AgNO3 + H2SO4 = Ag2SO4 + 2HNO3
Взаимодействие сульфата натрия даёт сульфат серебра и нитрат натрия :
2AgNO3 + Na2SO4 = Ag2SO4 + 2NaNO3
Реакция с ортофосфатом натрия даёт ортофосфат серебра и нитрат натрия :
3AgNO3 + Na3PO4 = Ag3PO4 + 3NaNO3
Реакция с соляной кислотой приводит к образованию хлорида серебра :
Реакция с хлором приводит к образованию оксида азота ( V ) кислорода и хлорида серебра реакция протекает в присутствии четырёх хлористого углерода ( катализатор ) при 0°C :
4AgNO3 + 2Cl2 = 4AgCl + 2N2O5 + O2
Реакция с сероводородом даёт сульфит серебра и азотную кислоту :
В зависимости от концентрации ( аммиачной воды , нашатырный спирт ) даёт разные реакции с концентрированным :
AgNO3 + 2(NH3 · H2O) = [Ag(NH3)2]NO3 + 2H2O
С разбавленной даёт оксид серебра ( I ) и аммиачную селитру :
2AgNO3 + 2(NH3 · H2O) = Ag2O + 2NH4NO3 + H2O
Подобно себя ведёт тиосульфат натрия в концентрированном состоянии даёт комплексное соединение и нитрат натрия :
AgNO3 + Na2SO3S = Na[Ag(SO3S)2] + NaNO3
В разбавленном состоянии даёт тиосульфат серебра :
2AgNO3 + Na2SO3S = Ag2SO3S + 2NaNO3
Реакция с концентрированными цианидами приводит к комплексному соединению дицианоаргентат( I ) натрия и нитрата натрия :
AgNO3 + 2NaCN = Na[Ag(CN)2] + NaNO3
С разбавленным цианид серебра и нитрат натрия :
С концентрированным роданид (тиоцианат) калия даёт комплексное соединение дицианоаргентумат калия и нитрат калия :
AgNO3 + 2KNCS = K[Ag(SCN)2] + KNO3
С разбавленным нитрат калия и тиоцианат серебра :
Концентрированный нитрит калия даёт комплексное соединение и нитрат калия :
AgNO3 + 2KNCS = K[Ag(SCN)2] + KNO3
С разбавленным нитрат калия и нитрит серебра :
2AgNO3 + 2KNO2 = AgNO2 + 2KNO3
Реакция с концентрированным с сульфитом натрия даёт комплексное соединение битиосульфатоаргенат ( I ) натрия и нитрат натрия :
AgNO3 + 2Na2SO3 = Na3[Ag(SO3)2] + NaNO3
С разбавленным сульфит серебра и нитрат натрия :
2AgNO3 + Na2SO3 = Ag2SO3 + 2NaNO3
Смесь нитрата серебра , аммиачной воды ( нашатырный спирт ) и формальдегида даёт реакцию серебряного зеркала :
2AgNO3 + 3(NH3 · H2O) + HC(H)O = 2Ag+ + NH4(HCOO) + 2NH4NO3 + 2H2O
Свойства нитрата серебра
Нитрат серебра белый порошок , который хорошо растворим в воде . Плотность 4,352 г/см³ . Молярная масса 169,87 г/моль , Температура плавления 209,7 °C При нагревании до 300 °C плавиться , повышение нагревания приводит к разложению соли на серебро , оксид азота и кислород .
Хорошо растворим в метаноле , пиридине , эфире , этаноле . Водный раствор нитрата серебра с альдегидом даёт реакцию серебряного зеркала.
Статья на тему нитрат серебра
Источник статьи: http://znaesh-kak.com/x/li/serebro/%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82-%D1%81%D0%B5%D1%80%D0%B5%D0%B1%D1%80%D0%B0
Нитрат Серебра
Химическое название
Химические свойства
Вещество также называют ляпис, азотнокислое серебро, «адский камень». Химическое соединение из неорганической химии, соль, образованная металлом и азотной кислотой. Молярная масса соединения = 169,9 грамм на моль. По своим физическим свойствам – это прозрачные бесцветные кристаллы, в форме мелких палочек и пластинок. Хорошо растворяется в воде и этиловом спирте. Вещество темнеет на свету, имеет жгуче-кислый вкус. Формула Нитрата Серебра: AgNO3, совпадает с рацемической формулой. Начинает разлагаться при температуре выше 300 градусов Цельсия.
Химические свойства
Раствор Нитрата Серебра реагирует с соляной кислотой и солями соляной кислоты. Во время реакции образуется белый творожистый осадок хлорида Ag, который не растворим в азотной кислоте. При действии высоких температур начинается разложение Нитрата Серебра (примерно 350 градусов), при этом выделяется металл, кислород и NO2. При электролизе раствора азотнокислого серебра на катоде выделяется Ag, а на аноде — кислород. Таким образом вещество диссоциирует на ионы Ag+ и NO3–.
Соль активно применяется в медицине; при проявке пленочных фотографий; входит в состав ляписного карандаша в комбинации с нитратом калия; при получении диоксана, растворителей для смягчения химикатов. Вещество используют при производстве аккумуляторов, в криминалистике, текстильной промышленности.
Фармакологическое действие
Прижигающее, противовоспалительное, антисептическое, бактерицидное, противомикробное.
Фармакодинамика и фармакокинетика
Нитрат Серебра вызывает денатурацию белковых молекул, связывая карбоксильные и сульфгидрильные группы, изменяя конформацию молекулы. Бактерицидное действие вещества возникает во время диссоциации соединения на ионы. При взаимодействии средства с белками образуется альбуминат серебра имеющий черную окраску. Вещество нарушает работу некоторых ферментных систем в микробных клетках. Лекарство обладает кратковременными бактерицидным и длительным бактериостатическим действием. Даже сильно разведенный раствор способен оказывает сильное бактерицидное действие.
При определенной концентрации ионов Ag вещество проявляется вяжущие и противовоспалительные свойства, так как преципитация происходит только в интерстициальных белках. При применении высоких концентраций лекарства, образуются рыхлые альбуминаты и значительно повреждаются клеточные мембраны и внутриклеточные структуры.
Показания к применению
Применение азотнокислого серебра:
Противопоказания
Побочные действия
Азотнокислое серебро может спровоцировать развитие аллергических реакций.
Нитрат Серебра, инструкция по применению (Способ и дозировка)
Применять наружно. Перед использованием следует проконсультироваться с врачом и четко соблюдать его рекомендации.
Передозировка
При длительном контакте вещества с кожей могут возникнуть глубокие ожоги.
Взаимодействие
Вещество разлагается при контакте с бромидами, хлоридами, йодидами и органикой.
Условия продажи
Может понадобиться рецепт.
Препараты, в которых содержится (Аналоги)
Азотнокислое серебро в сочетании с нитратом калия находится в Ляписном медицинском карандаше; входит в состав некоторых гомеопатических средств.
Отзывы
Отзывы о лекарственном средстве оставляют в основном при попытках избавиться от бородавок с помощью Ляписного карандаша:
- “… Использовала это средство в течение 2 месяцев на бородавке на руке. Сейчас она вроде сошла, только осталось маленькое красное пятнышко”;
- “… Мне карандаш не помог вообще. Что только не пробовала, пока не попала к врачу, и не удалила новообразование ультразвуком — все было напрасно”;
- “… Бородавки постепенно начали чернеть, эффект начал проявляться спустя несколько недель. После использования карандаша пока не появлялись более”.
Цена, где купить
Купить азотнокислое серебро удастся в интернет-магазине или аптечной сети. Купить Нитрат Серебра в аптеке в виде Медицинского Ляписного карандаша можно примерно за 120 рублей.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Источник статьи: http://medside.ru/nitrat-serebra