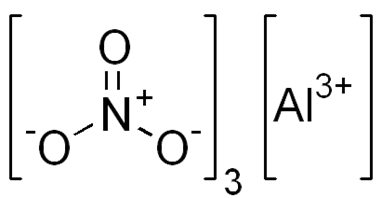Как пишется нитрат алюминия
Безводный нитрат алюминия представляет собой белое или бесцветное кристаллическое, чрезвычайно гигроскопичное вещество, дымящее на воздухе [2] [6] . Хорошо растворим в холодной воде (63,7 % при 25 °C) и полярных органических растворителях [6] . Температура плавления 66 °C (с разложением), в вакууме возгоняется при 50 °C [2] .
Нонагидрат Al(NO3)3•9H2O — белые кристаллы, расплывающееся на воздухе, с моноклинной структурой (a=1,086 нм, b=0,959 нм, c=1,383 нм, β=95,15°, z=4, пространственная группа P21/a). При нагревании чуть выше температуры плавления (73,6 °C) теряет сперва одну, а затем ещё две молекулы воды [2] .
Плотность водного раствора нитрата алюминия при 18 °C [7] :
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1006,5 | 1014,4 | 1030,5 | 1046,9 | 1063,8 | 1081,1 | 1098,9 | 1117,1 |
| 16 % | 18 % | 20 % | 24 % | 28 % | 30 % | 32 % | — | |
| 1135,7 | 1154,9 | 1174,5 | 1215,3 | 1258,2 | 1280,5 | 1303,6 | — |
Химические свойства
- При растворении в воде подвергается гидролизу[8] :

- Вступает в реакцию со щелочами:


- При нагревании разлагается [8] :

- Нитрат алюминия является сильным окислителем — его безводная форма со взрывом реагирует со многими органическими растворителями (например: с диэтиловым эфиром и бензолом).
Получение
Лабораторные методы
В лаборатории водный раствор нитрата алюминия получают растворением алюминия в разбавленной азотной кислоте:
Альтернативный метод заключается во взаимодействии гидроксида алюминия с азотной кислотой:
Наконец, искомую соль можно получить обменной реакцией сульфата алюминия с нитратом бария или свинца:
Из водного раствора посредством кристаллизации выделяют нонагидрат нитрата алюминия. Кристаллогидраты с меньшим количеством воды получают из водных растворов азотной кислоты [10] .
Безводный нитрат алюминия можно получить реакцией кристаллогидрата с избытком оксидом азота (V) (реакция (1)) или безводного хлорида алюминия с нитратом хлора (реакция (2)) [10] [11] :

Промышленное производство
В промышленности безводный нитрат алюминия получают взаимодействием оксида или гидроксида алюминия с оксидом азота (V) [8] :

В случае использования бромида алюминия в качестве исходного сырья для синтеза, реакция идёт в две стадии:

Применение
Соединение используется в текстильной промышленности как протрава при крашении тканей, для дубления кожи, в производстве нитей накаливания, в качестве катализатора при очистке нефти, антикоррозионного агента; в производстве изоляционных бумаг, нагревательных элементах, антиперспирантов; в ядерной физике [12] .
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/1360838
алюминия нитрат
АЛЮМИНИЯ НИТРАТ Al(NO3)3
бесцв. дымящие на воздухе кристаллы; т. пл. 66 °C ( с разл.); плотн. 1,89 г/см 3 ; 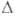
25 °C кристаллизуется нонагидрат AJ(NO3)3*9H2O — бесцв. расплывающиеся на воздухе кристаллы с моноклинной решеткой (а — 1,086 нм, b = 0,959 нм, с = 1,383 нм, 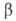
Лит.: Широкова Г.Н., Жук С.Я., Росоловский В.Я., «Ж. неорг. химии», 1976, т. 21, № 6, с. 1464–69.
Источник статьи: http://gufo.me/dict/chemistry_encyclopedia/%D0%B0%D0%BB%D1%8E%D0%BC%D0%B8%D0%BD%D0%B8%D1%8F_%D0%BD%D0%B8%D1%82%D1%80%D0%B0%D1%82
Формула нитрата алюминия
Определение и формула нитрата алюминия
Хорошо растворяется в воде (гидролизуется по катиону). Растворяется в азотной кислоте. Реагирует со щелочами, гидратом аммиака.
Рис. 1. Нитрат алюминия. Внешний вид.
Химическая формула нитрата алюминия
Химическая формула нитрата алюминия Al(NO3)3. Она показывает, что в состав данной молекулы входят один атом алюминия (Ar = 27 а.е.м.), три атома азота (Ar = 14 а.е.м.) и девять атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата алюминия:
Mr(Al(NO3)3) = 27 + 3×14 + 9×16 = 27 + 42 + 144 = 213.
Графическая (структурная) формула нитрата алюминия
Структурная (графическая) формула нитрата алюминия является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
Ионная формула
Нитрат алюминия представляет собой электролит, который диссоциирует на ионы в водном растворе согласно следующему уравнению реакции:
Примеры решения задач
| Задание | При нейтрализации 25,5 г предельной одноосновной кислоты избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты. |
| Решение | Запишем уравнение реакции нейтрализации предельной одноосновной кислоты избытком раствора гидрокарбоната натрия в общем виде: |
Рассчитаем количество вещества выделившегося в ходе реакции углекислого газа:
n(CO2) = 5,6 / 22,4 = 0,25 моль.
Рассчитаем молярную массу предельной одноосновной кислоты:
Определим число атомов углерода в молекуле предельной одноосновной кислоты (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода, 1 – для водорода и 16 для кислорода):
M(CnH2n+1COOH) = 12n + 2n + 1 + 12 + 16 + 16 +1 = 14n + 46;
14n + 46 = 102 г/моль;
Значит молекулярная формула предельной одноосновной кислоты C4H9COOH.
| Задание | Установите молекулярную формулу алкена, если известно, что 2,8 г его способны присоединить 1120 мл (н.у.) хлороводорода. |
| Решение | Запишем уравнение реакции присоединения хлороводорода к алкену в общем виде: |
Рассчитаем количество вещества хлороводорода:
n(HCl) = 1,2 / 22,4 = 0,05 моль.
Согласно уравнению реакции n(HCl): n(CnH2n) = 1:1, т.е. n(CnH2n) = n(HCl) = 0,05 моль.
Рассчитаем молярную массу алкена:
Определим число атомов углерода в молекуле алкена (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: 12 – для углерода и 1 – для водорода):
Значит молекулярная формула алкена C4H8.
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-nitrata-alyuminiya/