Готовимся к ЕГЭ по физике: что такое моль и молярная масса
В начале XIX в. английский физик и химик Джон Дальтон опубликовал таблицу атомных масс для двадцати элементов, в которой каждому элементу ставилась в соответствие его относительная масса по отношению к массе атома водорода. Таким образом, масса атома водорода в таблице Дальтона принималась равной 1. Некоторые вещества в таблице Дальтона элементами не являлись (например, известь). Но идея составления таблицы была правильной: каждому элементу приписать число, равное его относительной массе (по отношению к другому элементу, одинаковому для всех).
До 1961 г. в качестве такого другого элемента использовался изотоп кислорода O16. Затем вместо кислорода стали использовать изотоп углерода C12.
Логичным продолжением подхода Дальтона было определение моля. В настоящее время оно формулируется так: моль — это количество вещества, содержащее столько же атомов (или молекул), сколько содержится в 12 граммах углерода С12 (один из изотопов углерода). Из определения моля следует, что:
- моль углерода С12 равен 12 г;
- один моль любого вещества содержит одно и то же число молекул (это число было названо числом Авогадро). Число Авогадро (постоянная Авогадро) приблизительно равно 6,02·1023 моль-1.
Моль входит в число семи основных единиц Международной системы единиц Си.
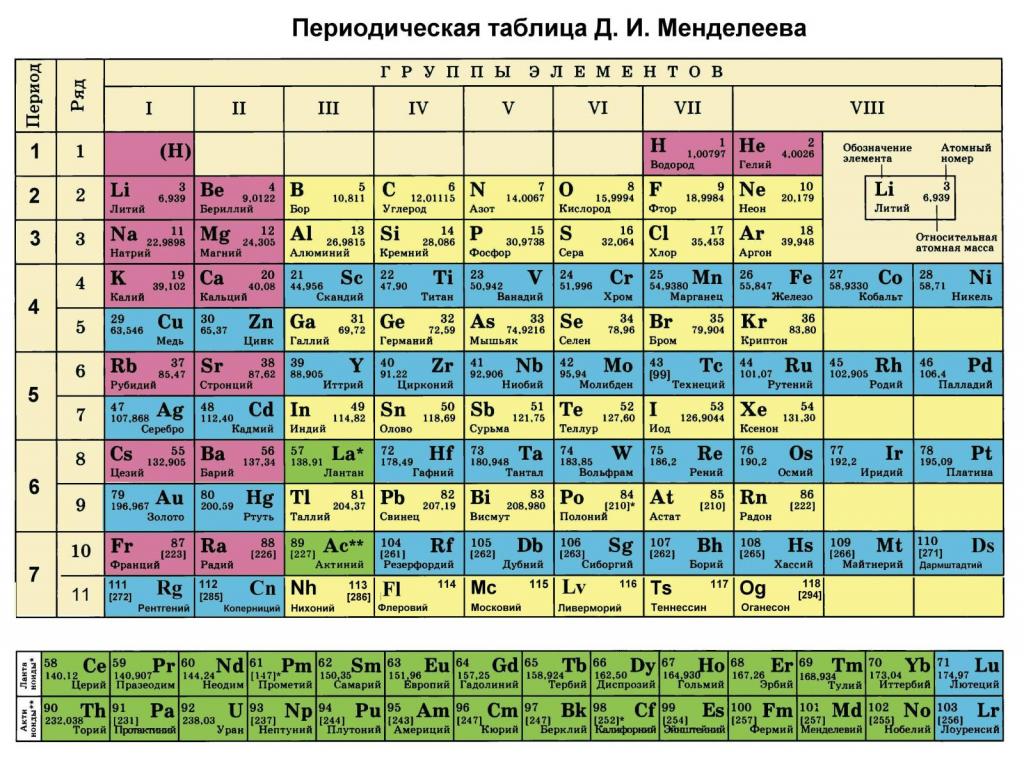
Масса одного моля вещества называется молярной массой. Молярная масса углерода С12 равна 12. Молярные массы остальных элементов можно найти в таблице Менделеева (число в правом вернем углу ячейки таблицы). Например, находим из таблицы молярные массы инертных газов гелия (He) 4 г/моль, аргона (Ar) 40 г/моль. А молярная масса, например, меди (Cu, читается “купрум”) равна 64 г/моль.
Измеряется молярная масса в г/моль (в системе Си в кг/моль). Часто молярная масса обозначается буквой M.
1/12 массы атома углерода С12 называется атомной единицей массы (а.е.м).
Рассмотрим, как узнать молярную массу вещества.
Если молекула вещества состоит из нескольких атомов, то нужно просуммировать молярные массы всех элементов, образующих данную молекулу.
Задачи на вычисление молярной массы являются составной частью многих задач химии.
1) Найдем молярную массу сульфата натрия Na2SO4.
Из таблицы Менделеева находим молярную массу натрия (Na) — 23, серы (S) — 32, кислорода (O) — 16. Тогда молярная масса Na2SO4 равна
Полученный результат означает, что 142 г сульфата натрия содержат 6,02·1023 молекул. Отсюда получаем, что одна молекула Na2SO4 имеет массу 142/(6,02·1023) = 23,6·10-23 г.
Решим обратную задачу нахождения массы заданного числа молей.
Найдем массу 0,75 молей азота N2 и 0,5 молей кислорода O2.
Молярная масса азота M(N2) = 2M(N), M(N2) = 2·14 = 28 г/моль.
Масса 0,75 молей азота равна 0,75·28 = 21 г.
Молярная масса кислорода M(O2) = 2M(O), M(O2) = 2·16 = 32 г/моль.
Масса 0,5 молей кислорода равна 0,5·32 = 16 г.
Для быстрого вычисления молярных масс можно использовать различные интернет-ресурсы:
При использовании калькулятора нужно выбрать элементы, из которых состоит вещество, ввести их количество и нажать кнопку “Рассчитать”.
- таблицу молярных масс. Ее можно найти, например, на сайте
Также много видеоуроков по данной теме есть на различных тематических каналах YouTube.
Пользуясь онлайн-калькулятором, можно быстро вычислить молярные массы сложных органических и неорганических веществ. Например, быстро находим, что молярная масса сахарозы (бытовое название — сахар) С12H22O11 равна 342,303 г/моль (калькулятор вводит молекулярные массы элементов с точностью до тысячных).
Согласно закону Авогадро для идеальных газов, 1 моль любого идеального газа при нормальных условиях (температура 0° С и давление воздуха 105 Па) занимает объем 22,4 л (1 л = 1дм3).
Найдем, какой объем занимает 1 г метана CH4.
Вычислим молярную массу метана:
1 г составляет 1/16 молей, которые занимают объем
Рассмотрим, как рассчитать молярную массу смеси газов. Пусть смесь состоит из n газов с массами m1, m2, . , mn. Молярные массы газов равны соответственно M1, M2, . , Mn. Тогда
M = (m1 + m2 + . mn)/n = (M1·n1 + M2·n2 + . + Mn·nn)/n .
Здесь n1, n2, . , nn — количество молей соответствующего газа в смеси.
где v1 = n1/n, . , vn = nn/n — молярные доли соответствующих газов.
Воздух представляет собой смесь газов: 78% азота, 21% кислорода, 1% аргона, 0,04% углекислого газа, небольшое количество других газов. Будем учитывать только доли азота (0,78), кислорода (0,22). Тогда
Поэтому при решении задач часто удобно рассматривать воздух как идеальный газ с молярной массой
Источник статьи: http://zen.yandex.ru/media/id/5c84134426978300b44fa0d6/gotovimsia-k-ege-po-fizike-chto-takoe-mol-i-moliarnaia-massa-5cc4e905c839c900b058cecf
Молярная масса
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Рис. 1. Формула числа Авогадро.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
где m – масса вещества, а v – количество вещества.
Рис. 2. Расчет молярной массы.
Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Рис. 3. Формула единицы атомной массы углерода.
Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Источник статьи: http://obrazovaka.ru/himiya/molyarnaya-massa-kak-nayti-8-klass.html
Школьникам (молекулярная физика и термодинамика. Моль вещества)
И молекулярная физика, и термодинамика изучают свойства вещества, но при этом пользуются разными методами.
Молекулярная физика рассматривает свойства вещества с точки зрения его внутренней структуры (движение молекул вещества, их взаимодействие).
Термодинамика не рассматривает внутреннюю структуру вещества, а интересуется его энергией, передачей энергии. Так, она рассматривает как за счёт тепла, полученного при сгорании топлива, можно получить работу (работа тепловой машины). О термодинамике будем говорить позднее, а пока речь пойдёт о молекулярной физике, которую ещё называют молекулярно-кинетической теорией или статистической физикой.
Молекулярная физика говорит о том, что любое вещество состоит из молекул. Металлы, имеющие кристаллическое строение,
состоят из атомов, но атомы можно считать одноатомными молекулами. Молекулы вещества находятся в непрерывном хаотическом движении (обладают кинетической энергией) и взаимодействуют друг с другом — одновременно притягиваются и отталкиваются (обладают потенциальной энергией взаимодействия).
На рисунке показан график зависимости силы взаимодействия молекул от расстояния между ними. Пунктирные линии относятся к силам притяжения и отталкивания, сплошная линия даёт результирующую силу взаимодействия молекул. При
эта сила равна нулю, что соответствует наиболее устойчивому состоянию молекул (наименьшему значению потенциальной энергии их взаимодействия).
Агрегатные состояния вещества определяются соотношением потенциальной и кинетической энергий молекул.
В газах молекулы находятся далеко друг от друга, их потенциальная энергия мала, а кинетическая велика., то есть
В кристаллических телах молекулы (атомы) располагаются вплотную друг к другу, их потенциальная энергия взаимодействия очень велика. Они обладают и кинетической энергией, совершая колебания около своих положений равновесия, но для них
В жидкостях, плотность которых меньше плотности твёрдых тел, молекулы и колеблются около положений равновесия, и время от времени совершают и поступательное движение. Кинетическая и потенциальная энергии молекул жидкости соизмеримы между собой
Так как молекулярная физика говорит о молекулах, то надо ввести понятия, связанные с молекулой — это масса молекулы, концентрация молекул и другие.
Один кг (или грамм) очень крупные для молекулы единицы массы, поэтому в молекулярной физике за единичную массу приняли 1/12 часть массы атома углерода (раньше единичную массу связывали с атомом водорода, кислорода):
Количество единичных масс в атоме назвали относительной атомной массой или просто атомной массой А , а количество единичных масс в молекуле — молекулярной массой М . Тогда молекула углерода содержит 12 единичных масс, так как
Для водорода А = 1, для кислорода А = 16 и так далее (см. таблицу Менделеева).
Молекулярная масса М складывается из атомных масс А. Так,
Источник статьи: http://zen.yandex.ru/media/id/5d94a74bc31e4900b2f962ce/shkolnikam-molekuliarnaia-fizika-i-termodinamika-mol-vescestva-5e99b71b65d5b620781eb978
Что такое молярная масса? Молярная масса в химии и физике газов
Каждый школьник, который внимательно изучал таблицу Менделеева, наверняка заметил, что, помимо номера химического элемента, в ней присутствует информация о весе его атома. В данной статье рассмотрим, что такое молярная масса и где она используется.
Что такое моль?
Прежде чем ответить на вопрос «что такое молярная масса», необходимо разобраться с такой важной величиной в химии, как моль.
В XIX веке Амедео Авогадро, внимательно изучая закон Гей-Люссака для идеальных газов при изохорном процессе, пришел к умозаключению, что в одинаковых объемах разных веществ при идентичных условиях (температура и давление) содержится равное число атомов или молекул. Идеи Авогадро противоречили теориям того времени о химическом строении и поведении газовых субстанций, поэтому они были приняты только спустя полвека.
В начале XX века с помощью более современных технологий удалось определить количество молекул водорода в 2 граммах этого газа. Это количество получило название «моль». Сам термин был введен Вильгельмом Оствальдом, с латыни он переводится как «куча», «скопление».
В 1971 году моль стал одной из 7 основных единиц измерения в системе СИ. В настоящее время под 1 молем понимают такое количество атомов кремния, которое содержится в идеальной сфере массой 0,028085 кг. Само число частиц, соответствующее 1 моль, называется числом Авогадро. Равно оно приблизительно 6,02*10 23 .
Что такое молярная масса?
Теперь можно вернуться к теме статьи. Моль и молярная масса — это две взаимосвязанные величины. Под второй понимают вес одного моль любого вещества. Очевидно, что тип химического элемента или состав молекулы того или иного газа напрямую определяет молярную массу. Согласно данному определению, можно записать следующее выражение:
Где ma — это масса одного атома, NA — число Авогадро. То есть для получения величины M необходимо умножить вес одной частицы (молекулы, атома, атомного кластера) на число Авогадро.
Как было отмечено во введении статьи, каждый элемент в периодической таблице содержит информацию о его атомной массе. Она представляет собой вес в граммах на моль. Очевидно, чтобы получить молярную массу в кг/моль, следует табличное значение разделить на 1000. Например, для ниобия под номером 41 мы видим цифру 92,9, то есть 1 моль его атомов имеет вес 92,9 грамма.
Где используется величина M в химии?
Зная теперь, что такое молярная масса, рассмотрим, где ее применяют в химии.
Понятие количества вещества и молярного веса играет важную роль при составлении химических реакций, поскольку они идут только при строгом соотношении реагентов. Для примера ниже приведена реакция сгорания водорода с образованием молекулы воды:
Видно, что 2 моль водорода, которые имеют массу 4 грамма, реагируют без остатка с 1 моль кислорода весом 32 грамма. В результате образуется 2 моль молекул воды, с показателем в 36 граммов. Из этих цифр ясно, что в процессе химических превращений масса сохраняется. В действительности же вес реагентов и продуктов превращения немного отличается. Эта небольшая разница связана с тепловым эффектом реакции. Разницу в массах можно рассчитать, если использовать формулу Эйнштейна для связи веса и энергии.
В химии понятие молярной массы также тесно связано с одноименной концентрацией. Обычно твердые вещества, которые растворимы в жидкостях, характеризуют количеством молей в одном литре, то есть молярной концентрацией.
Важно понимать, что рассматриваемая величина является постоянной только для данного химического элемента или конкретного соединения, например, для H2 она равна 2 г/моль, а для O3 — 48 г/моль. Если ее значение для одного соединения больше, чем для другого, то это означает, что сама элементарная частица первого вещества имеет большую массу, чем второго.
Газы и их молярный объем
Молярная масса также связана с физикой идеальных газов. В частности, ей пользуются во время определения объема газовой системы при конкретных внешних условиях, если известно количество вещества.
Идеальные газы описываются уравнением Клапейрона-Менделеева, которое имеет вид:
Здесь n — это количество вещества, которое с молярной массой связано так:
Объем газа можно определить, если известны его m, температура T и давление P, по следующей формуле:
Молярным объемом называется такой, который при 0 o C и давлении в одну атмосферу занимает 1 моль любого газа. Из формулы выше можно рассчитать эту величину, она составляет 22,4 литра.
Источник статьи: http://fb.ru/article/467281/chto-takoe-molyarnaya-massa-molyarnaya-massa-v-himii-i-fizike-gazov