Как пишется хлорид железа
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на жлезные опилки газообразным хлором. При этом, в отличии от действия соляной кислоты, образуется соль трёхвалентного железа:
2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа(II):
2FeCl2 + Cl2 → 2FeCl3
- Также существет достаточно интересный метод окисления оксидом серы(IV):
4FeCl2 + SO2 + 4HCl → 4FeCl3 + S + 2H2O
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления, начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
2FeCl3 → 2FeCl2 + Cl2↑
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комлексные соли тетрахлорожелезной кислоты:
FeCl3 + Cl − → [FeCl4] −
- При нагревании до 350°C с оксидом железа(III) образуется оксохлорид железа:
FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окислет металлическую медь, переводя её в растворимые хлориды:
FeCl3 + Cu → FeCl2 + CuCl FeCl3 + CuCl → FeCl2 + CuCl2
Применение
- Хлорид железа(III) применятеся для травлении печатных плат.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
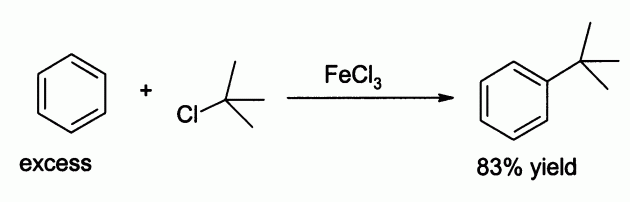
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое «Хлорид железа (III)» в других словарях:
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
хлорид железа(III) — трёххлористое железо, хлористое железо(III) … Cловарь химических синонимов I
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид гексаамминхрома(III) — Общие Систематическое наименование Хлорид гексаамминхрома(III) Традиционные названия гексамминхромихлорид Химическая формула [Сr(NH3)6]Cl3 Физические свойства … Википедия
Хлорид золота (III) — трихлорид золота AuCl3. Внешний вид красные моноклинные кристаллы. Молярная масса 303,33 г/моль. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом… … Википедия
Хлорид хрома (III) — Хлорид хрома(III) CrCl3. Свойства Фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152°С. При 600°С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). Получение В… … Википедия
Хлорид золота(III) — У этого термина существуют и другие значения, см. Хлорид золота. Хлорид золота(III) … Википедия
Хлорид железа(II,III) — Общие Систематическое наименование Хлорид железа(II,III) Традиционные названия Хлористое железо Химическая формула Fe3Cl8 Физические свойства … Википедия
Хлорид железа (II) — Хлорид железа(II) (хлористое железо) FeCl2 соль. Содержание 1 Свойства 2 Получение 3 Применение 4 См. также // … Википедия
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/246629
Хлорное железо — реактив, полезный для промышленности и радиолюбителей
Хлорное железо — неорганическое вещество, соль соляной кислоты 
Получают соединение различными способами, в том числе экономически дешевым методом — из отходов при производстве хлорида титана и хлорида алюминия.
Темные кристаллы с красновато-коричневым металлическим блеском, которые на воздухе быстро приобретают ржаво-коричневый цвет. Очень гигроскопичные, легко растворяются в воде, образуют несколько видов кристаллогидратов. Самый востребованный из них — железо хлорное 6-водное FeCl3 ∙ 6H2O. Растворение в воде сопровождается выделением тепла. Реактив растворяется в спиртах, ацетоне. При нагревании теряет часть хлора, превращаясь в хлорид двухвалентного железа.
Трихлорид железа обладает окислительными свойствами, вступает в реакции с медью и другими металлами, йодоводородом, оксидом железа (III), некоторыми хлоридами металлов. Качественной реакцией на реагент является реакция с фенолом. Несколько капель FeCl3 окрашивают раствор фенола в фиолетовый цвет.

Попадание брызг в глаза приводит к химическому ожогу. Если это произошло, следует немедленно их промыть и обратиться к врачу. Очень опасно проглатывание хлорного железа. Рабочее место должно быть оборудовано вентиляцией, так как вдыхать пары опасно.
Перевозить реактив можно любым видом транспорта. Хранят его в прохладных складах без отопления, без доступа солнечных лучей, в герметичной таре, защищающей от контакта с воздухом.
Раствор трихлорида железа коррозионно активен, поэтому его хранят в стойких к коррозии емкостях.
- Для быстрого осаждения части растворимых и большинства нерастворимых органических и неорганических примесей из производственных и бытовых сточных вод.
- Для осветления и умягчения воды в водоподготовке.
- В нефтедобыче для нейтрализации сероводорода при ремонте скважин; в нефтеперерабатывающей отрасли в качестве катализатора при производстве термостойких смол и битумов.
- В химпроме — катализатор при производстве органических веществ и материалов.
- В радиоэлектронике, промышленной и любительской, для травления плат, деталей, медной фольги.
- В печатном деле (цинкография, офорт) для изготовления печатных форм.
- В текстильной индустрии (относится к «мягким» протравам, не разрушающим волокна ткани).
- Для замены азотной кислоты в тех случаях, когда в результате реакции выделяется ядовитый оксид азота NO2.
- В качестве хлорирующего агента при извлечении нужных элементов из рудного сырья.
- Для удаления масла из сточных вод масложиркомбинатов; хрома из сточных вод кожевенных предприятий.
- В быту — для удаления гальванических покрытий на основе хрома и меди.
- В строительной индустрии добавляют в портландцемент для ускорения схватываемости и увеличения прочности бетона.
- В косметической, пищевой, пивоваренной, фармацевтической индустрии и ювелирном деле.
В продажу хлорное железо поступает в виде твердого вещества и в виде раствора. В магазине «ПраймКемикалсГрупп» вы можете купить 6-водное хлорное железо в виде кусков или кристаллов, оптом и в розницу. Есть скидки, возможность самовывоза и доставка.
Источник статьи: http://pcgroup.ru/blog/hlornoe-zhelezo-reaktiv-poleznyj-dlya-promyshlennosti-i-radiolyubitelej/
Как пишется хлорид железа
Хлорид железа (II) — Хлорид железа(II) (хлористое железо) FeCl2 соль. Содержание 1 Свойства 2 Получение 3 Применение 4 См. также // … Википедия
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
Хлорид железа — неорганическое соединение железа с хлором: Известны следующие хлориды железа: Хлорид железа(II); Хлорид железа(III) … Википедия
Хлорид железа(II,III) — Общие Систематическое наименование Хлорид железа(II,III) Традиционные названия Хлористое железо Химическая формула Fe3Cl8 Физические свойства … Википедия
Хлорид железа (III) — Хлорид железа(III) Общие Систематическое наименование Хлорид железа(III) Хими … Википедия
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
хлорид железа(III) — трёххлористое железо, хлористое железо(III) … Cловарь химических синонимов I
Хлорид водорода (соляная кислота) — Хлорид водорода (HCl) это бесцветный дымящийся газ с удушливым запахом, получаемым действием водорода (или воды и кокса) на хлор или действием серной кислоты на хлорид натрия. Он легко сжижается под давлением и легко растворим в воде. Хранится… … Официальная терминология
Железа хлориды — Хлорид железа: Хлорид железа(II) Хлорид железа(III) … Википедия
Хлорид натрия — Хлорид натрия … Википедия
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Источник статьи: http://translate.academic.ru/%D1%85%D0%BB%D0%BE%D1%80%D0%B8%D0%B4%20%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0/ru/en/