Как пишется хлорид серебра
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм [5] .
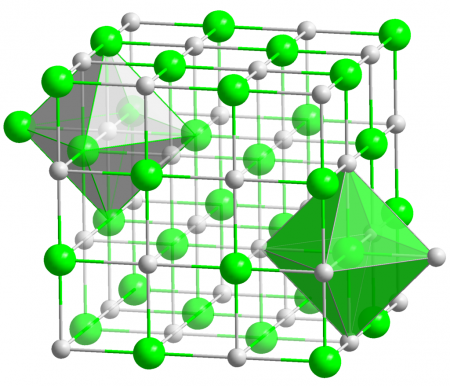
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6 [6] .
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера [6] .
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро» [7] .
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77·10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР=2,81·10 −8 [8] . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке [9] [4] .
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением [11] :
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Химические свойства
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра [12] :


- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении [14] :
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах [15] :
Применение
- Светочувствительный компонентфотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии [16] ;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды [13] :[стр. 167] :
- Реагент для получения сереброорганических соединений:
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/1349692
Хлорид серебра I
| Хлорид серебра I | ||
|---|---|---|
| ||
| Систематическое наименование | Хлорид серебра I | |
| Традиционные названия | Хлорид серебра | |
| Хим. формула | AgCl | |
| Рац. формула | AgCl | |
| Состояние | твёрдое | |
| Молярная масса | 143,32 г/моль | |
| Плотность | 5,56 | |
| Твёрдость | 2,5 | |
| Температура | ||
| • плавления | 455 | |
| • кипения | 1554 °C | |
| Мол. теплоёмк. | 50,79 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −127 кДж/моль | |
| Удельная теплота испарения | 1,28⋅10 6 | |
| Удельная теплота плавления | 9,2⋅10 4 | |
| Давление пара | 1 Па , 10 Па , 100 Па , 1 кПа , 10 кПа и 100 кПа | |
| Растворимость | ||
| • в воде | 1,91⋅10 −5 г/100 мл | |
| • в этаноле | 1,5·10 −5 г/л | |
| • в метаноле | 6·10 −5 г/л | |
| • в ацетоне | 1,3·10 −5 г/л | |
| • в пиридине | 19,5 г/л | |
| Показатель преломления | 2,071 | |
| Дипольный момент | 6,08 ± 0,06 Д | |
| Рег. номер CAS | 7783-90-6 | |
| PubChem | 24561 | |
| Рег. номер EINECS | 232-033-3 | |
| SMILES | ||
| RTECS | VW3563000 | |
| ChEBI | 30341 | |
| ChemSpider | 22967 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Содержание
Молекулярная и кристаллическая структура
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
AgCl + 2 NH3 ⋅ H2O = [Ag(NH3)2]Cl + 2 H2O AgCl + 2 Na2SO3S = Na3[Ag(SO3S)2] + NaCl AgCl + 2 KCN = K[Ag(CN)2] + KCl
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
AgCl + Cl − = [AgCl2] −
- Медленно реагирует с концентрированной серной кислотой при кипячении:
2 AgCl + H2SO4 = Ag2SO4 + 2 HCl ↑
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
2 AgCl + Ba(NO3)2 → NH 3 BaCl2 ↓ + 2 AgNO3
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
Ag2S + 2 NaCl + 2 O2 → 600∘C 2 AgCl + Na2SO4
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Источник статьи: http://chem.ru/hlorid-serebra-i.html