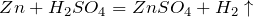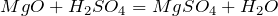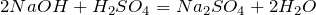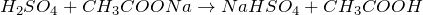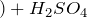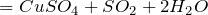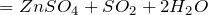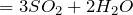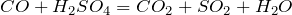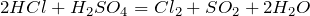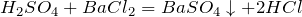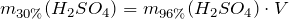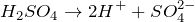Формула серной кислоты
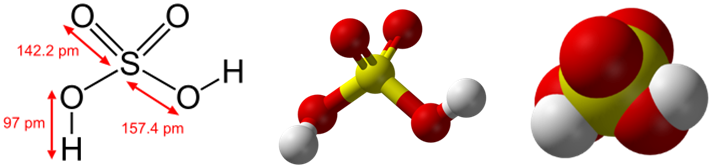
Химическая и структурная формула серной кислоты
Химическая формула: H2SO4
Молекулярная масса: 98,078г/моль.
Физические свойства серной кислоты
При обычных условиях – тяжёлая маслянистая жидкость без цвета и запаха (может иметь желтоватый оттенок), с кислым «медным» вкусом. Температура кристаллизации чистой серной кислоты +10°С.
Неограниченно смешивается с водой с выделением большого количества тепла, поэтому во избежание «вскипания» раствора всегда следует добавлять серную кислоту в воду, а не наоборот.
Раствор SO3 в серной кислоте называется олеум. Олеум содержит пиросерные кислоты, образующиеся по реакциям:
Серная кислота – сильная кислота, константа диссоциации Ка = 10 3 . Образует средние и кислые соли – сульфаты и гидросульфаты.
Химические свойства серной кислоты
Разбавленная серная кислота проявляет типичные свойства кислот:
- реагирует с металлами, находящимися в электрохимическом ряду напряжений до водорода с образованием сульфатов и выделением водорода:
реагирует с основными оксидами:
и с основаниями с образованием соответствующей соли и воды:
вытесняет более слабые кислоты из их солей:
Концентрированная серная активно поглощает пары воды, способна вытеснять воду из органических соединений, с образованием углерода, воды и выделением тепла (обугливание сахара):
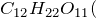
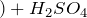
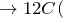
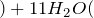
Концентрированная серная кислота – очень сильный окислитель:
окисляет металлы, вне зависимости от их положения в ряду напряжений (кроме золота и платины) восстанавливаясь при этом до SO2. Выделения водорода не происходит.
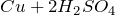
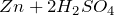
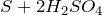
с кислотами – неокислителями:
Качественная реакция на сульфат-ион – взаимодействие с растворимыми солями бария, с образованием нерастворимого в воде и кислотах белого осадка сульфата бария:
Концентрированная серная кислота – очень едкое вещество. При попадании на живые ткани дегидрирует углеводороды, выделяя избыточное тепло, что приводит к вторичному термическому ожогу, дополнительно к химическому ожогу. Поэтому повреждения, вызываемые серной кислотой, потенциально более опасны, чем повреждения, вызванные другими кислотами.
Примеры решения задач
| Задание | Рассчитать, сколько мл 96%-ного раствора серной кислоты с плотностью 1,8355 г/см  необходимо взять для приготовления одного литра 30%-ного раствора (плотность 1,219 г/см необходимо взять для приготовления одного литра 30%-ного раствора (плотность 1,219 г/см )? )? |
| Решение | Масса серной кислоты в 1 л 30%-ного раствора равна: |
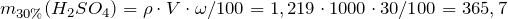
Масса серной кислоты в 1 мл 96%-ного раствора равна:
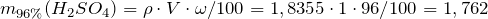
Объем 96%-ного раствора серной кислоты будет равен:
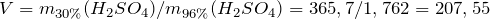
| Задание | К 3 л воды прибавили 2 мл 96% серной кислоты, плотность которой равна 1,84 г/мл. Вычислить pH полученного раствора. |
| Решение | Серная кислота – сильная кислота, в растворе полностью диссоциирует на ионы: |
Рассчитаем массу раствора серной кислоты:
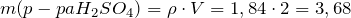
Рассчитаем массу серной кислоты в растворе:
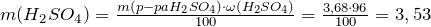
Молярная масса серной кислоты равна 98 г/моль.
Найдем количество вещества серной кислоты в растворе:
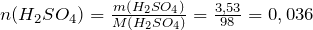
Суммарный объем раствора будет равен:
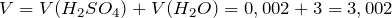
Рассчитаем молярную концентрацию серной кислоты:

Из уравнения реакции диссоциации серной кислоты следует, что концентрация ионов водорода равна:
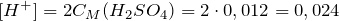
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-sernoj-kisloty/
Формула серной кислоты
Серная кислота (жирное масло) представляет собой сильную минеральную двухосновную кислоту, содержащую атом серы в наивысшей степени окисления (+6).
Химическая и структурная формула серной кислоты
Химическая формула: \(\ \mathrm
Молекулярный вес: 98,078 г / моль.
Физические свойства серной кислоты
В нормальных условиях это тяжелая жирная жидкость без цвета или запаха (может иметь желтоватый оттенок) с кислым «медным» вкусом. Температура кристаллизации чистой серной кислоты составляет + 10 ° С.
Неограниченное смешивание с водой с выделением большого количества тепла, поэтому, чтобы избежать «кипения» раствора, всегда следует добавлять серную кислоту в воду, а не наоборот.
Раствор \(\ \mathrm
Серная кислота представляет собой сильную кислоту, константу диссоциации Ka = 103. Формирует среду и кислотные соли — сульфаты и гидросульфаты.
Химические свойства серной кислоты
Разбавленная серная кислота проявляет типичные кислотные свойства:
реагирует с металлами в электрохимической серии напряжений на водород с образованием сульфатов и высвобождением водорода:
\(\ Z n+H_ <2>S O_<4>=Z n S O_<4>+H_ <2>\uparrow \)
реагирует с основными оксидами:
и основаниями для образования соответствующей соли и воды:
вытесняет более слабые кислоты из их солей:
Концентрированная серная кислота активно поглощает водяной пар, способна вытеснять воду из органических соединений с образованием углерода, воды и тепла (обугливая сахар):
\(\ C_ <12>H_<22>O<11>(сахароза)+H<2>SO_<4>(конц) \rightarrow 12C(уголь)+11 H_<2>O+H_<2>SO_ <4>\)
Концентрированная серная кислота является очень сильным окислителем:
окисляет металлы, независимо от их положения в серии напряжений (кроме золота и платины), при этом уменьшается до SO2. Водород не выпускается.
с оксидами неметаллических металлов:
с неокисляющими кислотами:
Качественная реакция на сульфатно-ионное взаимодействие с растворимыми солями бария с образованием нерастворимых в воде и кислоте белого осадка сульфата бария:
\(\ H_<2>SO_<4>+BaCl_<2>= BaSO_ <4>\downarrow +2HCl \)
Концентрированная серная кислота является очень едким веществом. При воздействии на живую ткань он обезвоживает углеводороды, высвобождая избыточное тепло, что приводит к вторичному термическому ожогу в дополнение к химическому ожогу. Поэтому ущерб, вызванный серной кислотой, потенциально опаснее, чем ущерб, вызванный другими кислотами.
К 3 л воды добавляли 2 мл 96% -ной серной кислоты, плотность которой составляла 1,84 г / мл. Вычислите рН полученного раствора.
Серная кислота является сильной кислотой, полностью диссоциирует в растворе в ионы:
\(\ H_ <2>S O_ <4>\rightarrow 2 H^<+>+S O_<4>^ <2->\)
Рассчитайте массу раствора серной кислоты:
\(\ m\left(p-p a H_ <2>S O_<4>\right)=\rho \cdot V=1,84 \cdot 2=3,68г \)
Рассчитайте массу серной кислоты в растворе:
Молярная масса серной кислоты составляет 98 г / моль.
Найдите количество вещества серной кислоты в растворе:
Общий объем решения будет равен:
\(\ V=V\left(H_ <2>S O_<4>\right)+V\left(H_ <2>O\right)=0,002+3=3,002л \)
Рассчитайте молярную концентрацию серной кислоты:
Из уравнения реакции для диссоциации серной кислоты следует, что концентрация ионов водорода равна:
\(\ \left[H^<+>\right]=2 C_
Рассчитайте pH полученного раствора:
\(\ p H=-l g\left[H^<+>\right]=-l g 0,024=1,62 \)
Значение рН полученного раствора серной кислоты составляет 1,62.
Источник статьи: http://sciterm.ru/spravochnik/formula-sernoj-kisloti/
Серная кислота — химические и физические свойства и реакции
Формула и физические свойства
Одно из основных соединений в промышленности — серная кислота — имеет химическую формулу H2SO4. Её молекула состоит из четырёх атомов кислорода, двух — водорода и одного — серы. Эта токсичная плотная маслянистая жидкость без запаха в очищенном состоянии не имеет цвета и обладает характерным «медным» привкусом. Плотность при нормальных условиях составляет 1,84 г/куб. см. Примеси придают неочищенному продукту желтоватую или буро-жёлтую окраску.
Соединение кипит при +296 °C, плавится при температуре +10,3 °C. Его кристаллы гигроскопичны и активно отнимают воду у всего окружающего, обугливают бумагу, древесину, сахар. Теплота гидратации при растворении столь велика, что вызывает вскипание смеси и разбрызгивание. Именно поэтому для смешения добавляют кислоту к воде, а не наоборот. Старинное название «купоросное масло» отсылает к XVIII—XIX вв. , когда серу для изготовления пороха получали разложением пирита на купоросных заводах. И до сих пор кристаллогидраты её солей именуются купоросами.
Медикам и строителям давно известен природный гипс — кристаллогидрат сульфата кальция. Садоводы и огородники любят медный купорос — ценный помощник в борьбе с различными вредителями и болезнями растений. Квасцы незаменимы в производстве красок и для дубления кожи. Десятиводный кристаллогидрат сульфата натрия — «глауберова соль» — используется в химической промышленности, деревопереработке и медицине (слабительное и желчегонное средство для людей и животных).
Сульфат бария или «бариевая каша» обладает уникальной способностью взаимодействовать с рентгеновским излучением, задерживая его, и это большой плюс при исследованиях полых органов человеческого тела.
Способы промышленного производства
В качестве сырья долгое время использовался природный минерал пирит — «серный колчедан». Сегодня ему на смену пришли элементарная сера или её соединения: сероводород, соли — сульфиты и сульфаты, а также газовые отходы теплоэлектростанций, работающих на неочищенной нефти. Производство имеет ряд последовательных стадий:
- Получение оксида серы (II), сернистого газа, путём сжигания серосодержащего сырья или его обжига в кислороде.
- Очистка газообразной фазы реагентов от твёрдых примесей.
- Окисление до оксида серы (III). Процесс описывается уравнением: 2SO2 + O2 = 2SO3.
- Поглощение водой: H2O + SO3 = H2SO4.
В общем объёме минеральных кислот, которые производятся сегодня химической промышленностью, H2SO4 занимает почётное первое место. При этом она является наиболее дешёвой, технологичной и не разрушает чёрные металлы в концентрированном состоянии.
Камерный метод получения
В эпоху средневековья алхимики синтезировали купоросное масло т. н. камерным способом. Для этого использовались специальные большие, размером с целую комнату, камеры, обложенные изнутри свинцом. Поверхности стенок в результате окисления покрывались защитным слоем сульфата свинца. При горении в присутствии воздуха смеси, состоящей из серы и калиевой селитры, образовывался твёрдый остаток оксидов азота и солей калия и выделялся газообразный оксид серы (III).
Он поглощался водой, имевшейся в камере, и позволял получить продукт малой крепости, которая требовала дальнейшей концентрации. После открытия каталитических свойств оксидов азота, камерный метод уступил место менее трудоёмким и более эффективным технологиям производства.
Современные способы синтеза
«Едва ли найдётся другое, искусственно добываемое вещество, столь часто применяемое в технике» — эти слова гениального русского учёного Д. И. Менделеева наглядно характеризуют ценность серной кислоты. Сегодня при её производстве используются две методики окисления диоксида серы:
- контактная, использующая твёрдые катализаторы;
- башенная (нитрозная), где катализаторами служат газообразные оксиды азота, а окислителем выступает кислород.
При контактном способе смесь реагентов пропускается сквозь твёрдый катализатор, расположенный слоями для увеличения поверхности. Нитрозный метод подразумевает орошение сырья водой или разбавленной кислотой в башенных реакторах. Первый способ более производителен и компактен, позволяет получать продукт большей чистоты при меньших затратах и постепенно вытесняет нитрозного конкурента.
Ускорителей процесса окисления было открыто немало. Наибольший эффект проявляют платина, оксиды ванадия V2O5 и железа Fe2O3. Но первая стоит дорого и быстро отравляется примесями мышьяка, содержащимися в газовой фазе SO2. Для поддержания каталитической активности оксида железа необходимы температуры свыше 600 °C. Наиболее экономичным признан ванадиевый катализатор — он и применяется в производстве.
При улавливании SO3 водой выделяется много тепла, и продукт закипает с образованием аэрозоля. Поэтому используется 100% концентрированная кислота, и получается олеум, который затем разбавляется до необходимых пропорций.
Химические свойства продукта
Серная кислота занимает привилегированное положение среди наиболее сильных минеральных кислот. Такую активность легко охарактеризовать высокой полярностью молекулярной связи водород — кислород, и, соответственно, лёгкостью её разрыва. Это придаёт H2SO4 не только ряд общих для всех соединений её класса свойств, например, взаимодействие кислот с металлами, но и специфические качества. Среди основных химических свойств стоит отметить:
- Действие на индикаторы. Кислая среда водных растворов изменяет окраску фиолетового лакмуса, метилового оранжевого и универсального индикатора — они приобретают красный цвет.
- Реакция диссоциации. В водном растворе проявляются свойства сильного электролита, и в результате двухступенчатой диссоциации соединение распадается на два однозарядных положительных иона водорода и сульфат-ион с двойным отрицательным зарядом.
- Взаимодействие с металлами. Разбавленная серная кислота может реагировать с металлами, которые стоят в электрохимическом ряду активности левее водорода. При этом образуется сернокислая соль, которая называется сульфатом, и водород. Сульфаты не имеют цвета, хорошо растворимы в воде и легко кристаллизуются.
- Реакция нейтрализации. В результате взаимодействия с растворимыми и нерастворимыми основаниями образуется сульфатная соль и вода. Молекула H2SO4 имеет два атома водорода, поэтому кислота — двухосновная, и для полной нейтрализации требуется две молекулы основания.
- Взаимодействие с основными оксидами. Соединения с кислородом одно- и двухвалентных металлов (MgO, FeO, Li2O, Na2O) тоже участвуют в реакции нейтрализации. При этом образуется сульфат металла из состава оксида и вода.
- Обменные реакции с солями более слабых или легколетучих кислот. Происходит вытеснение и в результате образуется сульфатная соль и кислота (или выделяется летучий газ, а вода остаётся в растворе). Выпадение белого нерастворимого осадка BaSO4 — это качественная реакция на сульфат-ионы.
Специфические свойства концентрированных растворов обусловлены структурными особенностями формулы серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной, четвёртой степени окисления. Поэтому он может только принимать электроны и сообщать соединению высокие окислительные свойства. Стоит отметить некоторые из них:
- Окисление большинства металлов, в т. ч. пассивных (цинк и медь). В этих реакциях водород уже не выделяется, а H2SO4 восстанавливается до сероводорода, серы или оксида серы (II). Это определяется концентрацией исходных компонентов и местом, которое занимает метал в электрохимическом ряду активности. Исключение составляют золото, железо, алюминий и платиноиды, поэтому для перевозки автомобильным и железнодорожным транспортом используют стальные цистерны.
- Окисление многих неметаллов. В результате реакции неметалл образует соединение с максимальным окислительным числом, а H2SO4 восстанавливается до оксида серы (IV).
- Окисление сложных соединений. При обработке калиевых солей галогеноводородных кислот (KBr или KI) образуется сульфатная соль и выделяется свободный галоген. Хлорид-ионы не окисляются до хлора и позволяют получать соляную кислоту реакцией обмена.
- Дегидратация органических веществ. Химически связанная вода легко удаляется из гидроксильных групп в присутствии концентрированной H2SO4: из этилового спирта образуется этилен. Обугливание углеводов тоже объясняется обезвоживанием.
Интересно, что в природе эта едкая кислота встречается в чистом 100%-м виде: на итальянском острове Сицилия существует уникальное Озеро смерти, к которому не приближаются даже насекомые и птицы. В этих местах дисульфид железа из земной коры выступает сырьём для синтеза H2SO4, и продукт сочится прямо из дна! Действующие вулканы тоже вносят вклад — извергают в земную атмосферу сернокислотные выбросы, которые причиняют непоправимый вред окружающей среде и становятся причиной серьёзных климатических изменений.
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
- добыча редких элементов (очистка урановых, иридиевых, циркониевых и осмиевых руд);
- производство минеральных удобрений, высокомолекулярных нитей, красок и пиротехники;
- неорганический синтез солей и кислот;
- текстильная и кожевенная отрасли;
- нефтехимия и металлообработка;
- пищевая промышленность (добавка-эмульгатор E513);
- автомобилестроение (электролит в аккумуляторах);
- дистиллирование воды (реагент для восстановления смол в фильтрах).
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.
При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.
Источник статьи: http://nauka.club/khimiya/sernaya-kislota.html