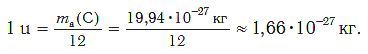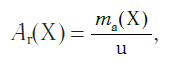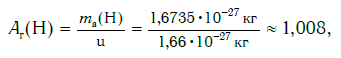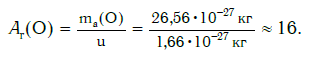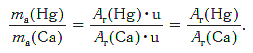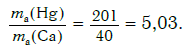Относительная атомная масса химических элементов
Размеры и массы молекул очень малы. Размеры и массы атомов ещё меньше. Масса самого лёгкого атома — атома водорода равна 1,67375 ⋅ 10−24 г, масса атома кислорода — 2,656812 ⋅ 10−23 г, а масса атома углерода — 1,9927 ⋅ 10−23 г. Производить расчёты с такими числами неудобно. Поэтому для измерения масс атомов и молекул была введена атомная единица массы (а. е. м.).
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а. е. м.
На Земле встречаются три разновидности атомов углерода, различающиеся массой. Такие разновидности атомов одного и того же элемента называют изотопами . В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают A r.
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
А r(Н) = 1,67375 ⋅ 10−24 г : 1,66054 ⋅ 10−24 г = 1,0078 (
А r(О) = 2,656812 ⋅ 10−23 г : 1,66054 ⋅ 10−24 г = 15,999 (
- ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА элемента ( А r) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г. В память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da).
Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.В прикреплённой таблице написаны относительные атомные массы некоторых химических элементов:
Источник статьи: http://zen.yandex.ru/media/id/5ea18ca322b6bd32eecb4f38/otnositelnaia-atomnaia-massa-himicheskih-elementov-5eb2fea7a3f457144fc03e5d
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
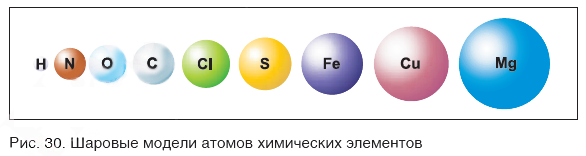
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
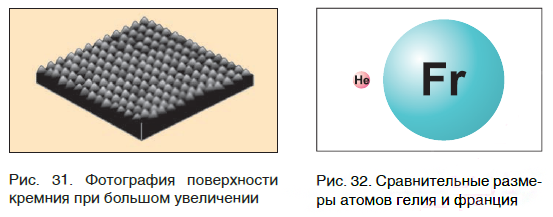
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u .
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-2-otnositelnaja-atomnaja-massa-himicheskih-jelementov.html
Как пишется атомная масса в химии
АТОМНАЯ МАССА — масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия (см., напр., Дефект массы) … Большой Энциклопедический словарь
Атомная масса — Atomic mass масса атома химического элемента, выраженная в атомных единицах массы (а.е.м.). За 1 а.е.м. принята 1/12 часть массы изотопа углерода с атомной массой 12. 1 а.е.м.=1,6605655·10 27 кг. Атомная масса складывается из масс всех протонов и … Термины атомной энергетики
атомная масса — – масса атомов элемента, выраженная в атомных единицах массы. Масса такого количества элемента, в котором содержится то же число атомов, что и в 12 г изотопа 12C. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
АТОМНАЯ МАССА — безразмерная величина. А. м. масса атома хим. элемента, выраженная в атомных единицах (см.) … Большая политехническая энциклопедия
АТОМНАЯ МАССА — (устаревший термин атомный вес), относительное значение массы атома, выраженное в атомных единицах массы (а. е. м.). А. м. меньше суммы масс составляющих атом ч ц на дефект масс. А. м. была взята Д. И. Менделеевым за осн. хар ку элемента при… … Физическая энциклопедия
атомная масса — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN atomic weight … Справочник технического переводчика
атомная масса — масса атома, выраженная в атомных единицах массы. За атомную массу химического элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учётом их процентного содержания (эта величина приведена в периодической… … Энциклопедический словарь
АТОМНАЯ МАССА — Понятие об этой величине претерпевало длительные изменения в соответствии с изменением представления об атомах. Согласно теории Дальтона (1803), все атомы одного и того же химического элемента идентичны и его атомная масса это число, равное… … Энциклопедия Кольера
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Cheminio elemento vidutinės masės ir nuklido ¹²C atomo masės 1/12 dalies dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse … Penkiakalbis aiškinamasis metrologijos terminų žodynas
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Vidutinės elemento atomų masės ir 1/12 nuklido ¹²C atomo masės dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/9109
Почему атомная масса в таблице Менделеева относительна?
В предыдущей серии мы рассчитали среднюю атомную массу хлора, значение, которое мы можем наблюдать в таблице Менделеева, и обозначили её как Ar ,что означает — Relative atomic mass, то есть, относительная атомная масса.
Почему в химии люди вынуждены оперировать относительными атомными массами и что скрывается за данным понятием? Попробуем разобраться.
Дело в том, что масса атома сама по себе крайне мала, так масса наиболее распространённого изотопа углерода C (12) равна 1,992*10^-23 грамма. То есть, ноль целых, затем идут двадцать три ноля, и лишь после этого получаем значащие после запятой цифры. Оперировать такими маленькими значениями очень неудобно, поэтому химики искали решение данной проблемы, решим её и мы.
Из чего состоит изотоп углерода С (12):
- Из 6 протонов (порядковый номер углерода в таблице Менделеева равен 6)
- 6 электронов ( атом электронейтрален )
- и 6 нейтронов (разница между атомной массой в таблице и порядковым номером).
Среди перечисленных частиц хоть сколько-нибудь значительной массой обладают лишь протоны и нейтроны (массы протона и нейтрона отличаются друг от друга, однако совсем незначительно), чьи массы равны: m (p+) = m (n)
Это значит, что мы можем при небольшом допущении принять так называемую атомную единицу массы (а.е.м.), если поделим массу изотопа углерода C (12) на 12 (сумма числа протонов и нейтронов):
причём данное значение (а.е.м.) будет примерно равно как массе протона, так и массе нейтрона: а.е.м = m (p+) = m (n)
Далее перейдём к водороду.
Атом водорода состоит из одного протона и одного электрона. Напомню, что масса электрона пренебрежимо мала. Это значит, что масса атома водорода примерно равна массе протона, то есть m (H) = m (p+) , а масса протона в свою очередь примерно равна значению а.е.м:
То есть, если мы поделим массу атома водорода на значение а.е.м., то получим 1! Что довольно-таки удобно.
Вот мы и подобрались к понятию относительной атомной массы Ar
Атомная масса — Ar в таблице Менделеева относительна, ведь является отношением реальной массы атома к значению а.е.м. ,что делает эту величину, во-первых, безразмерной (ведь при её рассчёте граммы делятся на граммы), а во вторых при некотором пренебрежении целочисленной , что очень удобно!
На этом наша четвёртая часть подошла к концу, и, если с атомной массой, протонами и нейтронами мы более менее разобрались, то в следующей серии поговорим об электронной оболочке!
Источник статьи: http://zen.yandex.ru/media/id/5e6da78c15b53f03073e4f88/pochemu-atomnaia-massa-v-tablice-mendeleeva-otnositelna-5e6e194853be0d0a19b23f22
Относительная атомная масса
Важной характеристикой отдельно взятого атома является его масса . Масса атома складывается из масс входящих в его состав протонов, нейтронов и электронов с учётом дефекта массы . Массой электронов в расчётах можно пренебрегать, так как она несоизмеримо мала по сравнению с массами покоя протона и нейтрона. Поэтому, вполне можно пользоваться понятием масса нуклида .
Напомним, что нуклид — это ядро атома с конкретным числом протонов и нейтронов.
Дефект массы – потеря ядром атома части массы при его синтезе из отдельных протонов и нейтронов.
Данная формула свидетельствует, что при ядерном синтезе ядро теряет часть массы с выделяющейся энергией. Поэтому масса ядра атома всегда меньше суммы масс покоя входящих в состав ядра протонов и нейтронов.
Разность между суммой масс покоя нуклонов (протонов и нейтронов), входящих в состав ядра и массой ядра и есть дефект массы .
Масса нуклида выраженная в килограммах называется абсолютной массой нуклида .
Во многих учебниках можно встретить информацию о том, что в расчётах величиной абсолютной массы, якобы, пользоваться не удобно, поэтому вводят величину относительной атомный массы. Но это заблуждение. Причина использования относительной атомной массы совершенно другая. Корни её кроются в истории.
Абсолютная масса очень маленькая величина. Для химиков и физиков 16-17 веков экспериментально её измерить было невозможно. Но даже в то время было важно проводить химические расчёты.
Первым учёным, решившим эту проблему, был Джон Дальтон, он предложил ввести величину относительной атомной массы (Аr) . Относительной она называется потому, что вычисляется по отношению к массе произвольно выбранного эталона. Дальтон выбрал за эталон массу самого лёгкого атома — атома водорода и, принял её равной 1.
Относительные атомные массы известных на то время элементов рассчитывались Дальтоном на основе открытым им закона кратных отношений.
В настоящее время за эталон выбрана 1/12 часть абсолютной массы нуклида 12С. Этот эталон принято называть атомной единицей массы , сокращённо а.е.м.
Источник статьи: http://zen.yandex.ru/media/disttutor/otnositelnaia-atomnaia-massa-5d72391380879d00ac1c2190