Как пишется атом в химии
Вещества состоят из атомов. Атом — частица вещества очень малых размеров и массы . Это самая маленькая часть химического элемента, которая является носителем его свойств.
Слово «атом» происходит от греческого атород — «неделимый», и таковой эта частица считалась долгие века. Однако уже в начале XX в. стала известна структура атома.
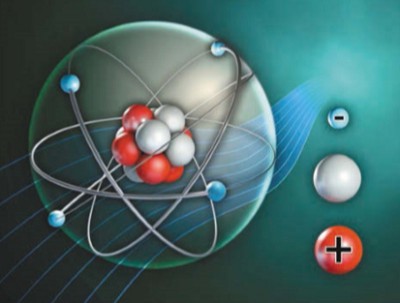
Атом состоит из атомного ядра и электронной оболочки. Сто лет назад считалось, что электроны вращаются вокруг ядра, как планеты вокруг Солнца. Так часто изображают атом для упрощения. На самом деле невозможно определить точку, где в данный момент находится электрон. Электрон заряжен отрицательно, а ядро — положительно. Само ядро также состоит из элементарных частиц — протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны электрически нейтральны. Обычно атом нейтрален. Это справедливо, когда число протонов в ядре такое же, как число электронов. Если у атома на внешней орбите имеется один или несколько дополнительных электронов, он превращается в отрицательно заряженный ион (анион). Если у атома на внешней орбите недостает одного или нескольких электронов, он превращается в положительно заряженный ион (катион). Таких ионов очень много в различных растворах.
Более 99% массы атома сосредоточено в ядре. На долю электронов приходится очень незначительная часть. Массу атома измеряют в атомных единицах массы, равных 1/12 массы атома стабильного изотопа углерода 12С.
Имеются атомы с одинаковым числом протонов, но с разным числом нейтронов.
Такие атомы называются изотопами (разновидностями) одного и того же элемента. Существует единственный из стабильных атомов, у которого в ядре вообще нет нейтронов, а имеется только один протон. Вокруг ядра вращается (точнее, создает оболочку) один электрон. Это легкий водород, или протий. Существует также тяжелый водород — дейтерий. У него в ядре имеются две частицы — протон и нейтрон. Есть еще и сверхтяжелый водород — тритий. У него в ядре имеются три частицы — один протон и два нейтрона. А электрон у всех этих изотопов один. Вода, образованная дейтерием, называется тяжелой водой.
Атомы образуют межатомные связи и формируют молекулы. Молекулы могут состоять как из одного вида атомов, так и из нескольких.
Есть ли у атомов крючки?
Понятие об атоме как самой маленькой неделимой частице материи ввели более 2000 лет назад философы Древней Индии и Древней Греции. Греческий философ Демокрит говорил: «Нет ничего, кроме атомов, вечно движущихся в бесконечной пустоте». Он считал, что свойства вещества определяются формой, массой и другими свойствами атома. По Демокриту, огонь обжигает потому, что атомы огня острые, твердые тела такие потому, что их атомы шероховаты и намертво сцеплены друг с другом. Философ Эпикур писал, что этого не может быть, ведь крючки у атомов обломались бы. Но до открытия истинной структуры атома было еще далеко.
Источник статьи: http://sitekid.ru/himiya/atom.html
Как устроен атом простыми словами?
Атомы — мельчайшие частицы, из которых состоит все вокруг: все, что нас окружает, состоит из молекул, состоящих из атомов. Их невозможно увидеть с использованием каких бы то ни было увеличительных приборов в силу их невероятно маленьких размеров. Но ведь атомы тоже должны из чего-то состоять. Значит, должны существовать еще более маленькие частицы. Сразу говорю, это довольна непростая для понимания тема, поэтому текста много, да и читать нужно вдумчиво. Тем не менее, это крайне увлекательно — знать о настолько малых частицах, которые невозможно даже увидеть. Что ж, давайте разбираться!
Немного о самом атоме
Вообще, термин «атом» был изобретен очень давно: за 400 лет до н. э. греческий философ Демокрит выдвинул идею, что вещество можно делить до тех пор, пока не будут получены его наименьшие возможные частицы, названные атомами. Конечно, в гипотезе Демокрита атомы являются совсем не тем, чем их считают сейчас, но, тем не менее, идея атомизма очень древняя. В 1808 г. химик Джон Дальтон сформулировал атомистическую теорию: все вещества состоят из атомов, мельчайших неделимых частиц, которые нельзя ни создать, ни уничтожить. Также, Дальтон утверждал, что атомы одного и того же элемента абсолютно одинаковы. Так зародилась атомистическая теория, и было заложено начало к изучению самих атомов.
Теперь немного о характеристиках атома. Не для кого не секрет, что атом чрезвычайно мал. Но даже его можно измерить — а именно указать его массу и диаметр. Диаметры атомов в среднем — 0,2 нм (0,0000000002 м). Массы рознятся сильнее: от 10 в минус 27 степени (ноль с двадцатью шестью нолями и единицей после запятой) кг до 10 в минус 25 степени ( ноль с двадцатью четырьмя нолями и единицей после запятой) кг. Для избежания участия столь малых цифр в расчетах, массы атомов обычно выражают в атомных единицах массы (а. е. м.). 1 а. е. м. = 1,661 на 10 в минус 27 степени.
Какие частицы входят в состав атома?
Мы уже представляли себе атом таким, каким его рисуют в sci-fi фильмах: ядро, состоящее из протонов и нейтронов в центре, и электроны, вращающиеся вокруг ядра. Но что представляют из себя протоны, нейтроны и электроны?
Нейтрон — это элементарная незаряженная частица. Электрический заряд равен 0 е , масса равна 1 а. е. м. Нейтрон был открыт в 1932 г. Чедвиком в ходе ядерной реакции между атомами бериллия и гелия. Нейтрон входит в состав атомного ядра
Протон — это элементарная положительная частица. Электрический заряд равен +1 е , масса равна 1 а. е. м. Открыт в 1919 г. Резерфордом. Входит в состав атомного ядра вместе с нейтроном, представляет собой ядро атома водорода.
Электрон — это элементарная отрицательная частица. Электрический заряд равен -1 е (равен по модулю заряду протона), масса равна 0,00054 а. е. м., поэтому для простоты расчетов считается, что электрон не имеет массы. Открыт в 1897 г. Томсоном при изучении поведения катодных лучей (электронов) в магнитном и электрическом поле. Электроны не входят в состав ядра, а находятся снаружи, двигаясь по специальным траекториям, но об этом позднее.
Как частицы располагаются в атоме?
Ученые Гейгер и Марсден в 1909 г. проводили бомбардировку золотой фольги альфа-частицами (ядрами гелия). Частицы проходили через фольгу, как и ожидалось, однако, малая их часть отражалась обратно. Примерно 1 из 8000 частиц отскакивали. Был сделан вывод, что частицы сталкиваются с положительными и тяжелыми центрами, которые должны располагаться в ничтожно малой части атома, раз так мало частиц отражается обратно. Так появилось представление об атомном ядре: отражались только те частицы, которые сталкивались с ядрами. Таким образом, атомное ядро имеет намного меньший размер, чем сам атом; остальное пространство в атоме занимают электроны. И если с ядром все понятно — лишь малая часть атома, состоящая из протонов и нейтронов, то с электронами все сложнее.
В 1925 г. Шредингер сформулировал свое уравнение, названное в его честь. Оно позволяло проследить поведение электрона в атоме. Однако, в силу принципа неопределенности Гейзенберга (электрон обладает частично-волновым дуализмом) нельзя определить точное положение электрона и его скорость. Можно лишь говорить об области пространства, где электрон находится чаще. Так появился термин атомная орбиталь — это место, где вероятность нахождения электрона составляет больше 90%. Вот и получаем первое различие с изображениями из фильмов: там электроны вращаются вокруг ядра, оставляя следы в виде полосок. На деле электроны как бы расплываются вокруг ядра. Физик Бор сформулировал постулат о том, что электроны могут обладать определенным количеством энергии, а не произвольным. Так были введены квантовые числа:
- главное квантовое число (n, положительное целое число — 1, 2, 3. ) характеризует энергетический уровень электрона и указывает число подуровней на уровне;
- орбитальное квантовое число (l, неотрицательное целое число — 0, 1, 2. ) характеризует форму атомной орбитали, на которой находится электрон;
- магнитное квантовое число (ml, целое число от -l до +l) характеризует количество атомных орбиталей на энергетическом подуровне;
- спиновое квантовое число (ms, значения — либо -1/2, либо +1/2) характеризует вращение электрона относительно собственной оси.
У каждого электрона в атоме свой набор квантовых чисел, на основании которых можно оценить его энергию, по которой можно судить о его местоположении в атоме. В заполнении электронами атомных орбиталей участвуют некоторые закономерности. Одна из них — это запрет Паули . Он гласит о том, что в атоме не может быть двух электронов с одинаковыми наборами всех квантовых чисел, т. е. обладающих одинаковыми энергиями.
Немного об атомных орбиталях
Другое отличие реального атома от киношного изображения — это изображение атомных орбиталей. На картинках электроны движутся по окружностям. В реальности электроны не только расплываются, но и делают это по определенной области — орбитали. На каждой атомной орбитали может находится только 2 электрона. Всего различают 5 видов орбиталей в зависимости от значения орбитального квантового числа l:
- l = 0 — s-орбиталь;
- l = 1 — p-орбиталь;
- l = 2 — d-орбиталь;
- l = 3 — f-орбиталь;
- l = 4 — g-орбиталь.
s-орбиталь представляет собой симметричную относительно ядра сферу. Вероятность нахождения электрона на каждом участке орбитали одинакова. Всего на s-орбитали может располагаться два электрона.
p-орбиталь представляет собой форму гантели. Она направлена в трех разных направлениях — по координатным осям x, y и z и в совокупности они образуют энергетический подуровень.
Источник статьи: http://zen.yandex.ru/media/id/5d2c4f4043bee300ae19d1f7/kak-ustroen-atom-prostymi-slovami-5d433dc9ce44a000ad2dc59d
Как обозначается атом в химии?
Могут ли или существуют ли вещества во Вселенной, которых нет в таблице Менделеева?
Безусловно. Потому что в таблице Менделеева вообще нет веществ, там только элементы.
Могут ли быть элементы, которых нет в таблице Менделеева? Тоже да. Можно делать атомы не только из протонов, нейтронов и электронов. Есть позитроний, есть мюоний, есть мюонные атомы. Для них в принципе нет места в таблице, но их умеют делать и даже заставлять вступать в реакции.
Далее, по сути, любая нейтронная звезда — это огромное атомное ядро, при желании можно прикинуть количество оставшихся в живых после коллапса протонов и выдать получившемуся атому полагающееся ему место в периодической системе.
1 9 · Хороший ответ
Из чего состоит атом?
Из протонов, нейтронов и электронов. В свою очередь протоны и нейтроны состоят из элементарных частиц кварков связазаных глюонами. Электроны находятся в зоне вероятного обнаружения вокруг ядра. Они там не вращаются как планеты вокруг солнца. Они как бы одновременно везде
Чем характеризуется атом?
Атом — наименьшая часть химического элемента, носитель его свойств. Его характеристики:
Источник статьи: http://yandex.ru/q/question/hw.nature/kak_oboznachaetsia_atom_v_khimii_f8d5ec8d/