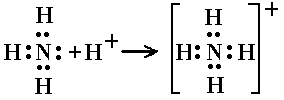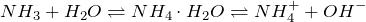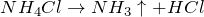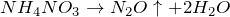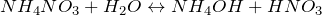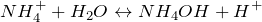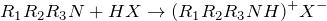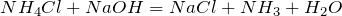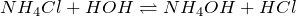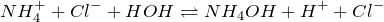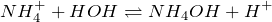АММОНИЙ
Словарь иностранных слов, вошедших в состав русского языка.- Чудинов А.Н. , 1910 .
Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней.- Михельсон А.Д. , 1865 .
Полный словарь иностранных слов, вошедших в употребление в русском языке.- Попов М. , 1907 .
Словарь иностранных слов, вошедших в состав русского языка.- Павленков Ф. , 1907 .
Новый словарь иностранных слов.- by EdwART, , 2009 .
Большой словарь иностранных слов.- Издательство «ИДДК» , 2007 .
Толковый словарь иностранных слов Л. П. Крысина.- М: Русский язык , 1998 .
Смотреть что такое «АММОНИЙ» в других словарях:
АММОНИЙ — АММОНИЙ ( Αμμώνιος), сын Гермия (между 435 445 между 517 526, Александрия) представитель Александрийской школы неоплатонизма, преподаватель философии, не пренебрегавший геометрией и астрономией. Комментарии Аммония к Аристотелю пользовались… … Философская энциклопедия
Аммоний — я, муж. Стар. редк.Отч.: Аммониевич, Аммониевна.Производные: Моня.Происхождение: (От др. евр. ’amon искусный мастер, художник.)Именины: 23 янв., 8 февр., 10 сент., 14 сент., 17 сент., 17 окт. Словарь личных имён. Аммоний Посвященный Амону, егип.… … Словарь личных имен
АММОНИЙ — АММОНИЙ, аммония, мн. нет, муж. (см. аммониак). 1. Соединение азота и водорода, не встречающееся в свободном состоянии, а лишь как составная часть сложных соединений, напр. в нашатыре (хлористый аммоний) и др. (хим.). 2. То же, что углекислый… … Толковый словарь Ушакова
аммоний — нашатырь Словарь русских синонимов. аммоний сущ., кол во синонимов: 2 • нашатырь (6) • удо … Словарь синонимов
АММОНИЙ — NH4+, однозарядный катион. Входит в состав нитрата аммония NH4NO3, сульфата аммония. (NH4)2SO4 и др. солей аммония … Большой Энциклопедический словарь
АММОНИЙ — АММОНИЙ, я, муж. Не существующее в свободном виде соединение атомов азота и водорода, обладающее химическими свойствами металлов. | прил. аммониевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Аммоний — (NH+4) неорганический радикал; входит в молекулы многих химических соединений, в свободном виде не существует. Широко применяют соли А. (аммониевые соли). Гидроксид А. (гидроокись А.) NH4OH образуется при растворении аммиака в воде … Российская энциклопедия по охране труда
АММОНИЙ — АММОНИЙ, NH4, хим. радикал, не получающийся в свободном состоянии. Впервые Ампер (1817 г.) и затем Берцелиус указали, что соединение аммиака с водой следует рассматривать как водную окись металлоподоб ного соединения, как «сложный… … Большая медицинская энциклопедия
аммоний — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN ammonium The radical NH4+. (Source: MGH) [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] Тематики охрана окружающей среды EN ammonium DE Ammonium FR ammonium … Справочник технического переводчика
Аммоний — У этого термина существуют и другие значения, см. Аммоний (значения). Модель катиона аммония … Википедия
Источник статьи: http://dic.academic.ru/dic.nsf/dic_fwords/3869/%D0%90%D0%9C%D0%9C%D0%9E%D0%9D%D0%98%D0%99
Что такое аммоний и где его используют
Содержание статьи
Аммоний – химическое вещество, образующееся в результате взаимодействия атомов азота и водорода (формула – NH4), активно использующееся в различных сферах деятельности человека. Аммоний обнаруживается в составе более сложных соединений и никогда в чистом виде. К таким соединениям относятся: хлорид аммония или нашатырь, при взаимодействии с водой образующий нашатырный спирт, сульфат аммония, аммоний ацетат, нитрат аммония.
В природе возникновение подобных соединений связано с вулканической активностью планеты, соли хлорида аммония присутствуют в почве и горных породах в местах разломов земной коры, в пещерах, вблизи часто извергающихся вулканов. Незначительное количество нашатыря образуется в процессе разложения продуктов жизнедеятельности животных. В промышленных масштабах аммоний получают в лабораторных условиях.
Использование аммония в промышленности
Сфера применения этого вещества чрезвычайно широка – от производства строительных материалов до пищевой промышленности.
Хлорид аммония получил название нашатыря, это вещество представляет собой белый мелкокристаллический порошок, хорошо растворимый в воде и не имеющий запаха, используется при производстве стали, в качестве удобрения в сельском хозяйстве, как лекарственный препарат, обладающий диуретическим действием, в медицине.
Сульфат аммония – это порошок без запаха и цвета, хорошо растворимый в воде и разлагающийся при нагревании до 250°С. Основные сферы применения: пищевая, химическая, горнодобывающая промышленность, производство кормов для животных, строительных материалов. Сульфат аммония обладает легким дезинфицирующим действием, используется в разработке вакцин.
Аммония ацетат – бесцветный или белый кристаллический порошок, получаемый при взаимодействии раствора аммиака с уксусной кислотой. Наиболее часто применяется в химической промышленности, при изготовлении и хранении изделий из кожи, в качестве консерванта при производстве некоторых продуктов питания.
Нитрат аммония, или аммиачная селитра – белый порошок, образующийся при взаимодействии аммиака и азотной кислоты, хорошо растворяется в воде, пиридине и этаноле, взрывоопасен при нагревании выше 270°С. Основная сфера применения: сельское хозяйство (в качестве удобрения).
Аммоний как пищевая добавка
Различные соединения аммония применяются в пищевой промышленности в качестве консерванта и пищевой добавки:
Е510 (хлорид аммония). Используется в основном в хлебобулочном производстве в качестве разрыхлителя теста, в пивоварении для ускорения процесса брожения пива. В ряде стран пищевая добавка Е510 запрещена, в России добавляется в дрожжи, приправы, соусы, мучные изделия.
Е517 (сульфат аммония). Применяется в качестве заменителя соли, эмульгатора, ускоряет процесс поднятия хлеба, улучшает качество муки, вещество разрешено к употреблению в пищу в России и странах ЕС.
Е264 (ацетат аммония). Способствует увеличению срока годности пищевых продуктов, предотвращает появление плесени, улучшает вкус, запрещен к употреблению в большинстве стран мира, в том числе в России.
Источник статьи: http://www.kakprosto.ru/kak-888973-chto-takoe-ammoniy-i-gde-ego-ispolzuyut
Формула аммония
Определение и формула аммония
Химическая формула NH4 +
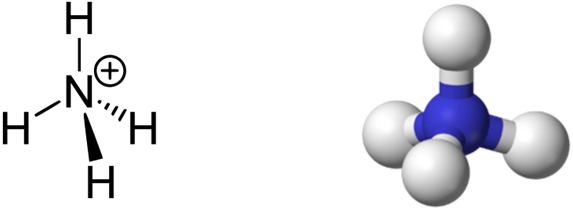
Ион аммония NH4 + является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра.
Образование иона аммония
В молекуле аммиака NH3 три электронные пары образуют три связи N – H, четвертая, прина длежащая атому азота электронная пара является неподеленной. С помощью этой электронной пары образуется связь с ионом водорода, который имеет свободную орбиталь:
Таким образом, в ионе аммония три ковалентные связи образуются по обменному механизму, а одна – по донорно-акцепторному. Механизм образования не оказывает слияния на характеристики связи, все связи в катионе аммония равноценны.
Соединения аммония
Катион аммония может образовывать с различными противоионами аммонивые соединения, в которых положительно заряженный атом азота, ковалентно связан с ионами водорода и (или) с органическими радикалами, а ионно – с каким-либо анионом.
Неорганические соединения аммония
Гидрат аммиака (гидроксид аммония, аммиачная вода, едкий аммоний, едкий аммиак). Формула: NH3·H2O
Образуется при взаимодействии аммиака с водой. Слабое основание, диссоциирует в воде с образованием катионов аммония и гидроксид-ионов:
Реакция обратима, поэтому водные растворы гидроксида аммония всегда имеют характерный резкий запах аммиака.
Соли аммония
Все соли аммония по своим свойствам похожи на соответствующие соли натрия. Хорошо растворяются в воде, полностью диссоциируют в водном растворе, при нагревании разлагаются:
В растворе гидролизуются по катиону:
Органические аммониевые соединения разделяют по количеству органических радикалов, связанных с атомом азота на первичные (R 1NH3) + X – , вторичные (R 1R2NH2) + X – , третичные (R1R2R3NH) + X – , и четвертичные (R1R2R3R4N) + X – .
Первичные, вторичные и третичные аммониевые соединения можно рассматривать как соли соответствующих аминов, их можно получить взаимодействием этих аминов с кислотами:
где R1,R2, R3 — органические радикалы или водород, X — анион кислотного остатка.
Качественная реакция на ионы аммония – взаимодействие со щелочами с выделением аммиака:
Примеры решения задач
| Задание | Какое значение рН (больше или меньше 7) имеет водный раствор хлорида аммония? Запишите молекулярное и ионно-молекулярное уравнения гидролиза. |
| Решение | Хлорид аммония NH4Cl – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. |
Полное ионное уравнение:
Краткое ионное уравнение:
В процессе гидролиза образовались водорода (H + ), поэтому раствор имеет кислую среду (pH ПРИМЕР 2
| Задание | Какая масса соли образуется при взаимодействии 44,8 л аммиака и 33,6 литров хлороводорода (нормальные условия)? |
| Решение | Запишем уравнение реакции: |
Молярные массы аммиака, хлороводорода и образующейся соли – хлорида аммония (NH4Cl) равны:
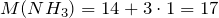
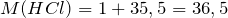
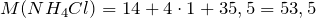
Сколько соли образуется.
Рассчитаем исходные количества аммиака и хлородоводорода с учетом того, что 1 моль газа при нормальных условиях занимает объем 22,4л:
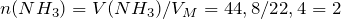
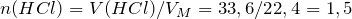
По уравнению реакции
Следовательно, аммиак взят в избытке. Расчет будем вести по хлороводороду.
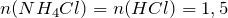
Масса хлорида аммония будет равна:
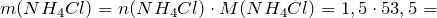
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ammoniya/