Изомерия в органической химии
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
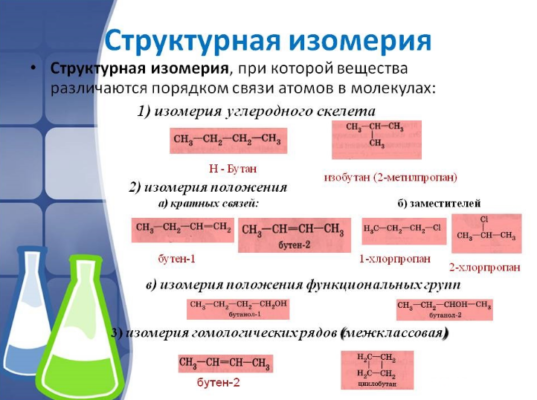
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию) .
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы . Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

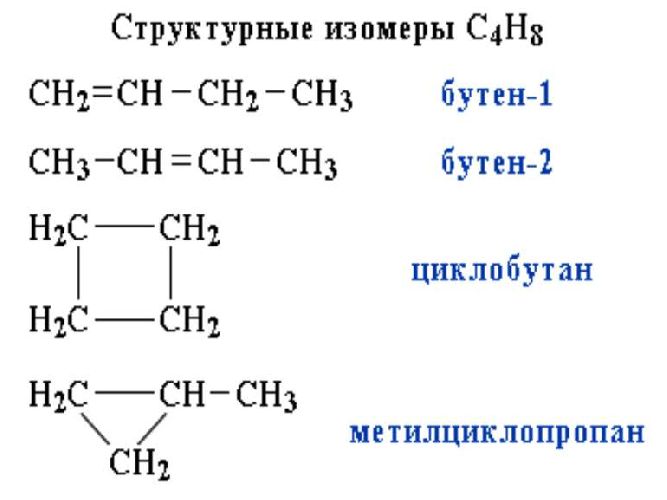
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Источник статьи: http://chemege.ru/izomeriya/
Изомерия
Классификация
Изомерия бывает двух типов:
- структурная – соединения отличаются строением молекул;
- пространственная – одинаковые по составу и строению вещества различаются пространственным расположением атомов.
Рис. 1. Структурная изомерия.
Описание каждого типа представлено в таблице.
Определение
Изомеры отличаются положением метильной группы -СН3 в углеродной цепи (может присоединяться к любому атому углерода)
Изомеры отличаются по положению:
- кратных связей – разное положение двойных связей в молекуле: СН2=СН-СН2-СН3 (бутен-1) и СН3-СН=СН-СН3 (бутен-2);
- функциональной группы – присоединение группы к любому атому углерода в цепи: СН3-СН2-СН2-СН2ОН (бутанол-1) и СН3-СН2-СНОН-СН3 (бутанол-2);
- заместителя – перемещение радикала в углеродной цепи: CH3-CHCl-CH2-CH3 (2-хлорбутан) и CH2Cl-CH2-CH2-CH3 (1-хлорбутан)
Из-за расположения функциональной группы образуется вещество другого класса: CH3-CH2-OH (этанол) и CH3-O-CH3 (диметиловый эфир)
Оптическая или зеркальная
Изомеры зеркально отражают друг друга
Изомеры отличаются положением радикалов относительно плоскости. Характерна для классов веществ, содержащих двойные связи, а также для циклических соединений. Бывает двух типов:
- цис-изомерия – радикалы находятся по одну сторону плоскости;
- транс-изомерия – радикалы лежат по разным сторонам плоскости
Рис. 2. Пространственная изомерия.
Чем больше атомов углерода в молекуле, тем больше изомеров может образовывать соединение.
Номенклатура
Названия изомеров состоят из трёх частей:
- номер атома углерода, к которому присоединены дополнительные группы;
- название группы;
- название главной цепи.
За главную цепь принимается самая длинная цепочка атомов углерода. Например, если к цепи из пяти атомов углерода присоединена цепочка из двух атомов углерода, главной считается пятиуглеродная цепь.
Отсчёт атомов начинается с конца с разветвлением или большим количеством разветвлений. Структурная формула изомерии помогает наглядно определить, какой атом является первым.
Примеры изомеров с названиями:
- СН3-СН(СН3)-СН2-СН2-СН3 – 2-метилпентан (метильная группа находится у второго атома углерода);
- СН3-СН2-СН(СН3)-СН2-СН3 – 3-метилпентан;
- СН3-СН(СН3)-СОН – 2-метилпропаналь.
Рис. 3. Структурные формулы изомеров с названиями.
Изомеры имеют одинаковую молекулярную формулу, но разные структурные формулы.
Что мы узнали?
Из урока химии 10 класса узнали о явлении изомерии. Изомеры – соединения с одинаковым количеством атомов, но с разным строением или пространственным положением. При структурной изомерии меняется положение в углеродной цепи двойной связи, метильной группы или радикала. Пространственная изомерия бывает двух типов – оптическая (зеркальная) и геометрическая. Структурные названия изомеров обуславливаются положением функциональных групп и радикалов.
Источник статьи: http://obrazovaka.ru/himiya/izomeriya-strukturnye-formuly-10-klass.html
Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Названия предельных углеводородов (алканов) линейного строения
| Название алкана | Молекулярная формула | Структурная формула | Агрегатное состояние | Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– |  | Сl– | F– | Br– | –NO2 |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |