Урок 1. Схема строения атомов
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
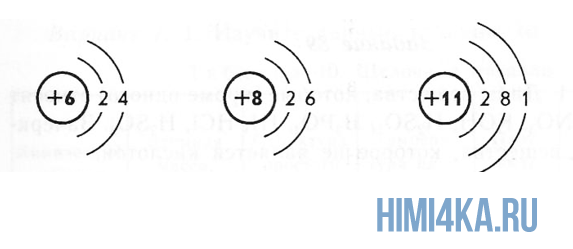
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
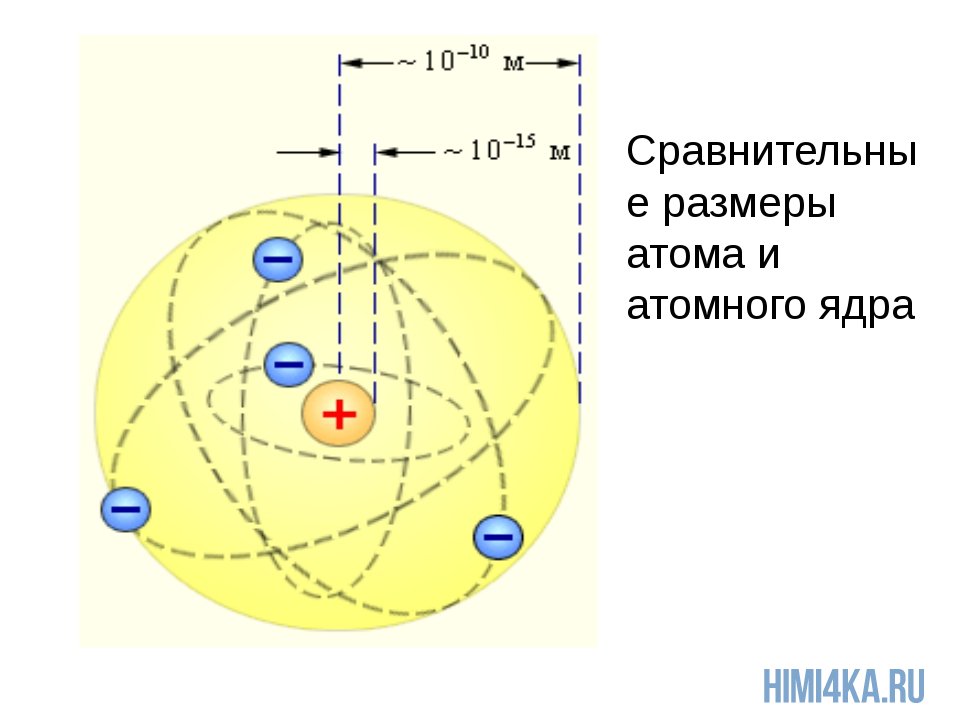
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона
1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала , поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×10 23 а.е.м и наоборот 1 а.е.м. = 1,66×10 -24 г. Число 6,022×10 23 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10 -19 | 1,67·10 -24 | 1,00728 |
| Нейтрон | 0 | 1,67·10 -24 | 1,00866 |
| Электрон | -1,6·10 -19 | 9,10·10 -28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
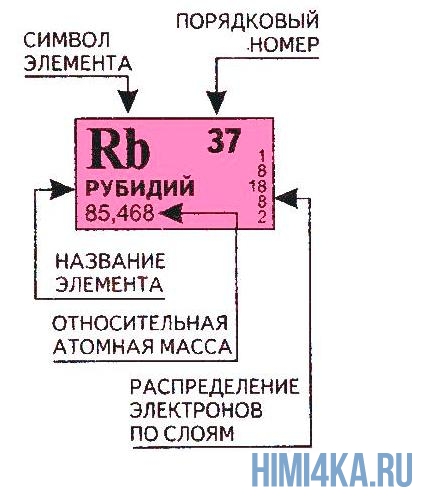
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-1-shema-stroenija-atomov.html
Как устроен атом простыми словами?
Атомы — мельчайшие частицы, из которых состоит все вокруг: все, что нас окружает, состоит из молекул, состоящих из атомов. Их невозможно увидеть с использованием каких бы то ни было увеличительных приборов в силу их невероятно маленьких размеров. Но ведь атомы тоже должны из чего-то состоять. Значит, должны существовать еще более маленькие частицы. Сразу говорю, это довольна непростая для понимания тема, поэтому текста много, да и читать нужно вдумчиво. Тем не менее, это крайне увлекательно — знать о настолько малых частицах, которые невозможно даже увидеть. Что ж, давайте разбираться!
Немного о самом атоме
Вообще, термин «атом» был изобретен очень давно: за 400 лет до н. э. греческий философ Демокрит выдвинул идею, что вещество можно делить до тех пор, пока не будут получены его наименьшие возможные частицы, названные атомами. Конечно, в гипотезе Демокрита атомы являются совсем не тем, чем их считают сейчас, но, тем не менее, идея атомизма очень древняя. В 1808 г. химик Джон Дальтон сформулировал атомистическую теорию: все вещества состоят из атомов, мельчайших неделимых частиц, которые нельзя ни создать, ни уничтожить. Также, Дальтон утверждал, что атомы одного и того же элемента абсолютно одинаковы. Так зародилась атомистическая теория, и было заложено начало к изучению самих атомов.
Теперь немного о характеристиках атома. Не для кого не секрет, что атом чрезвычайно мал. Но даже его можно измерить — а именно указать его массу и диаметр. Диаметры атомов в среднем — 0,2 нм (0,0000000002 м). Массы рознятся сильнее: от 10 в минус 27 степени (ноль с двадцатью шестью нолями и единицей после запятой) кг до 10 в минус 25 степени ( ноль с двадцатью четырьмя нолями и единицей после запятой) кг. Для избежания участия столь малых цифр в расчетах, массы атомов обычно выражают в атомных единицах массы (а. е. м.). 1 а. е. м. = 1,661 на 10 в минус 27 степени.
Какие частицы входят в состав атома?
Мы уже представляли себе атом таким, каким его рисуют в sci-fi фильмах: ядро, состоящее из протонов и нейтронов в центре, и электроны, вращающиеся вокруг ядра. Но что представляют из себя протоны, нейтроны и электроны?
Нейтрон — это элементарная незаряженная частица. Электрический заряд равен 0 е , масса равна 1 а. е. м. Нейтрон был открыт в 1932 г. Чедвиком в ходе ядерной реакции между атомами бериллия и гелия. Нейтрон входит в состав атомного ядра
Протон — это элементарная положительная частица. Электрический заряд равен +1 е , масса равна 1 а. е. м. Открыт в 1919 г. Резерфордом. Входит в состав атомного ядра вместе с нейтроном, представляет собой ядро атома водорода.
Электрон — это элементарная отрицательная частица. Электрический заряд равен -1 е (равен по модулю заряду протона), масса равна 0,00054 а. е. м., поэтому для простоты расчетов считается, что электрон не имеет массы. Открыт в 1897 г. Томсоном при изучении поведения катодных лучей (электронов) в магнитном и электрическом поле. Электроны не входят в состав ядра, а находятся снаружи, двигаясь по специальным траекториям, но об этом позднее.
Как частицы располагаются в атоме?
Ученые Гейгер и Марсден в 1909 г. проводили бомбардировку золотой фольги альфа-частицами (ядрами гелия). Частицы проходили через фольгу, как и ожидалось, однако, малая их часть отражалась обратно. Примерно 1 из 8000 частиц отскакивали. Был сделан вывод, что частицы сталкиваются с положительными и тяжелыми центрами, которые должны располагаться в ничтожно малой части атома, раз так мало частиц отражается обратно. Так появилось представление об атомном ядре: отражались только те частицы, которые сталкивались с ядрами. Таким образом, атомное ядро имеет намного меньший размер, чем сам атом; остальное пространство в атоме занимают электроны. И если с ядром все понятно — лишь малая часть атома, состоящая из протонов и нейтронов, то с электронами все сложнее.
В 1925 г. Шредингер сформулировал свое уравнение, названное в его честь. Оно позволяло проследить поведение электрона в атоме. Однако, в силу принципа неопределенности Гейзенберга (электрон обладает частично-волновым дуализмом) нельзя определить точное положение электрона и его скорость. Можно лишь говорить об области пространства, где электрон находится чаще. Так появился термин атомная орбиталь — это место, где вероятность нахождения электрона составляет больше 90%. Вот и получаем первое различие с изображениями из фильмов: там электроны вращаются вокруг ядра, оставляя следы в виде полосок. На деле электроны как бы расплываются вокруг ядра. Физик Бор сформулировал постулат о том, что электроны могут обладать определенным количеством энергии, а не произвольным. Так были введены квантовые числа:
- главное квантовое число (n, положительное целое число — 1, 2, 3. ) характеризует энергетический уровень электрона и указывает число подуровней на уровне;
- орбитальное квантовое число (l, неотрицательное целое число — 0, 1, 2. ) характеризует форму атомной орбитали, на которой находится электрон;
- магнитное квантовое число (ml, целое число от -l до +l) характеризует количество атомных орбиталей на энергетическом подуровне;
- спиновое квантовое число (ms, значения — либо -1/2, либо +1/2) характеризует вращение электрона относительно собственной оси.
У каждого электрона в атоме свой набор квантовых чисел, на основании которых можно оценить его энергию, по которой можно судить о его местоположении в атоме. В заполнении электронами атомных орбиталей участвуют некоторые закономерности. Одна из них — это запрет Паули . Он гласит о том, что в атоме не может быть двух электронов с одинаковыми наборами всех квантовых чисел, т. е. обладающих одинаковыми энергиями.
Немного об атомных орбиталях
Другое отличие реального атома от киношного изображения — это изображение атомных орбиталей. На картинках электроны движутся по окружностям. В реальности электроны не только расплываются, но и делают это по определенной области — орбитали. На каждой атомной орбитали может находится только 2 электрона. Всего различают 5 видов орбиталей в зависимости от значения орбитального квантового числа l:
- l = 0 — s-орбиталь;
- l = 1 — p-орбиталь;
- l = 2 — d-орбиталь;
- l = 3 — f-орбиталь;
- l = 4 — g-орбиталь.
s-орбиталь представляет собой симметричную относительно ядра сферу. Вероятность нахождения электрона на каждом участке орбитали одинакова. Всего на s-орбитали может располагаться два электрона.
p-орбиталь представляет собой форму гантели. Она направлена в трех разных направлениях — по координатным осям x, y и z и в совокупности они образуют энергетический подуровень.
Источник статьи: http://zen.yandex.ru/media/id/5d2c4f4043bee300ae19d1f7/kak-ustroen-atom-prostymi-slovami-5d433dc9ce44a000ad2dc59d
Строение атома
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Одну из первых моделей строения атома — « пудинговую модель » — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой .
А томное ядро, как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны . Они связаны ядерными силами (сильное взаимодействие).
Рассмотрим основные характеристики протонов, нейтронов и электронов:
| Протон | Нейтрон | Электрон | |
| Масса | 1,00728 а.е.м. | 1,00867 а.е.м. | 1/1960 а.е.м. |
| Заряд | + 1 элементарный заряд | 0 | — 1 элементарный заряд |
1 а.е.м. (атомная единица массы) = 1,66054·10 -27 кг
1 элементарный заряд = 1,60219·10 -19 Кл
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома . Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов, т.е. номеру атома в Периодической системе химических элементов.
Атом — это на заряженная частица, следовательно, число протонов равно числу электронов: Ne = Np = Z.
Масса атома ( массовое число A ) равна суммарной массе крупных частиц, которе входят в состав атома — протонов и нейтронов. Поскольку масса протона и нетрона примерно равна 1 атомной единице массы, можно использовать формулу: M = Np + Nn
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
Таким образом, рассчитать число нейтронов в атоме можно, вычтя из массового числа номер атома: Nn = M – Z.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным ( стационарным ) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни .
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень . Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1 . На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 0 | 1 | 2 | 3 | 4 |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
АО
 2
2 2
2

 6
6Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной .
Например , заполнение 2р-орбитали тремя электронами будет происходить так: 
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | 4 |
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s 2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например , электронная формула углерода выглядит так: 1s 2 2s 2 2p 2 .
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например , электронную формулу азота можно записать так: 1s 2 2s 2 2p 3 или так: [He]2s 2 2p 3 .
1s 2 2s 2 2p 6 = [Ne]
1s 2 2s 2 2p 6 3s 2 3p 6 = [Ar] и так далее.
Электронные формулы элементов первых четырех периодов
Рассмотрим заполнение электронами оболочки элементов первых четырех периодов. У водорода заполняется самый первый энергетический уровень, s-подуровень, на нем расположен 1 электрон:
+1H 1s 1 1s
У гелия 1s-орбиталь полностью заполнена:
+2He 1s 2 1s
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
+3Li 1s 2 2s 1 1s 
У бериллия 2s-подуровень заполнен:
+4Be 1s 2 2s 2 1s 
Далее, у бора заполняется p-подуровень второго уровня:
+5B 1s 2 2s 2 2p 1 1s 

У следующего элемента, углерода , очередной электрон, согласно правилу Хунда, заполняет вакантную орбиталь, а не заполняет частично занятую:
+6C 1s 2 2s 2 2p 2 1s 

Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
6. Кислород
У неона завершено заполнение второго энергетического уровня:
+10Ne 1s 2 2s 2 2p 6 1s 

У натрия начинается заполнение третьего энергетического уровня:
+11Na 1s 2 2s 2 2p 6 3s 1 1s 


От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
9. Алюминий
10. Кремний
А вот начиная с 19-го элемента, калия , иногда начинается путаница — заполняется не 3d-орбиталь, а 4s. Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей , а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия :
+19K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 1s




Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s 1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s 2 [Ar] 4s
У элемента 21, скандия , согласно энергетическому ряду орбиталей, начинается заполнение 3d-подуровня:
+21Sc [Ar]3d 1 4s 2 [Ar] 4s 
Дальнейшее заполнение 3d-подуровня происходит согласно квантовым правилам, от титана до ванадия :
+22Ti [Ar]3d 2 4s 2 [Ar] 4s 
+23V [Ar]3d 3 4s 2 [Ar] 4s 
Однако, у следующего элемента порядок заполнения орбиталей нарушается. Электронная конфигурация хрома такая:
+24Cr [Ar]3d 5 4s 1 [Ar] 4s 
В чём же дело? А дело в том, что при «традиционном» порядке заполнения орбиталей (соответственно, неверном в данном случае — 3d 4 4s 2 ) ровно одна ячейка в d-подуровне оставалась бы незаполненной. Оказалось, что такое заполнение энергетически менее выгодно. А более выгодно, когда d-орбиталь заполнена полностью, хотя бы единичными электронами. Этот лишний электрон переходит с 4s-подуровня. И небольшие затраты энергии на перескок электрона с 4s-подуровня с лихвой покрывает энергетический эффект от заполнения всех 3d-орбителей. Этот эффект так и называется — провал или проскок электрона . И наблюдается он, когда d-орбиталь недозаполнена на 1 электрон (по одному электрону в ячейке или по два).
У следующих элементов «традиционный» порядок заполнения орбиталей снова возвращается. Конфигурация марганца :
+25Mn [Ar]3d 5 4s 2
Аналогично у кобальта и никеля . А вот у меди мы снова наблюдаем провал (проскок) электрона — электрон опять проскакивает с 4s-подуровня на 3d-подуровень :
+29Cu [Ar]3d 10 4s 1
На цинке завершается заполнение 3d-подуровня:
+30Zn [Ar]3d 10 4s 2
У следующих элементов, от галлия до криптона , происходит заполнение 4p-подуровня по квантовым правилам. Например, электронная формула галлия :
+31Ga [Ar]3d 10 4s 2 4p 1
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Внешний энергетический уровень — это энергетический уровень в атоме с максимальным номером, на котором есть электроны. Например , у меди ([Ar]3d 10 4s 1 ) внешний энергетический уровень — четвёртый.
Валентные электроны — электроны в атоме, которые могут участвоват ьв образовании химической связи. Например, у хрома (+24Cr [Ar]3d 5 4s 1 ) валентными являются не только электроны внешнего энергетического уровня (4s 1 ), но и неспаренные электроны на 3d-подуровне, т.к. они могут образовывать химические связи.
Основное и возбужденнео состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома . Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи , атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов . А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться , и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается, и атом может образовать больше химических связей, что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
+5B 1s 2 2s 2 2p 1 1s 

На втором уровне (внешнем) одна спаренная электронная пара, один одиночный электрон и пара свободных (вакантных) орбиталей. Следовательно, есть возможность для перехода электрона из пары на вакантную орбиталь, получаем возбуждённое состояние атома бора (обозначается звёздочкой):
+5B* 1s 2 2s 1 2p 2 1s 

Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
15. Углерода
16. Бериллия
17. Кислорода
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы .
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы . Например : катион натрия образуется так:
+11Na 1s 2 2s 2 2p 6 3s 1 -1е = +11Na + 1s 2 2s 2 2p 6 3s 0
Если атом принимает электроны, то приобретает отрицательный заряд . Отрицательно заряженные частицы — это анионы . Например , анион хлора обраузется так:
+17Cl 1s 2 2s 2 2p 6 3s 2 3p 5 +1e = +17Cl — 1s 2 2s 2 2p 6 3s 2 3p 6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома. Обратите внимание , при образовании катионов электроны уходят с внешнего энергетического уровня . При образовании анионов электроны приходят на внешний энергетический уровень .
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са 2+
19. Ион S 2-
20. Ион Ni 2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами .
Например , ионы Na + и F — .
Электронная формула катиона натрия: Na + 1s 2 2s 2 2p 6 , всего 10 электронов.
Электронная формула аниона фтора: F — 1s 2 2s 2 2p 6 , всего 10 электронов.
Таким образом, ионы Na + и F — — изоэлектронные. Также они изоэлектронны атому аргона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома -81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота :
+7N 1s 2 2s 2 2p 3 1s 

6. Электронная формула кислорода :
+8О 1s 2 2s 2 2p 4 1s 

7. Электронная формула фтора :
8. Электронная формула магния :
+12Mg 1s 2 2s 2 2p 6 3s 2 1s 


9. Электронная формула алюминия :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 



10. Электронная формула кремния :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2 1s 



11. Электронная формула фосфора :
+15P 1s 2 2s 2 2p 6 3s 2 3p 3 1s 



12. Электронная формула серы :
+16S 1s 2 2s 2 2p 6 3s 2 3p 4 1s 



13. Электронная формула хлора :
14. Электронная формула аргона :
+18Ar 1s 2 2s 2 2p 6 3s 2 3p 6 1s 



15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s 2 2s 1 2p 3 1s 

16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s 2 2s 1 2p 1 1s 

17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са 2+ : +20Ca 2+ 1s 2 2s 2 2p 6 3s 2 3p 6
19. Электронная формула аниона серы S 2- : +16S 2- 1s 2 2s 2 2p 6 3s 2 3p 6
20. Электронная формула катиона никеля Ni 2+ : +28Ni 2+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 0 . Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня.
Источник статьи: http://chemege.ru/stroenie-atoma-2/