Схема строения атома
Схема строения атома
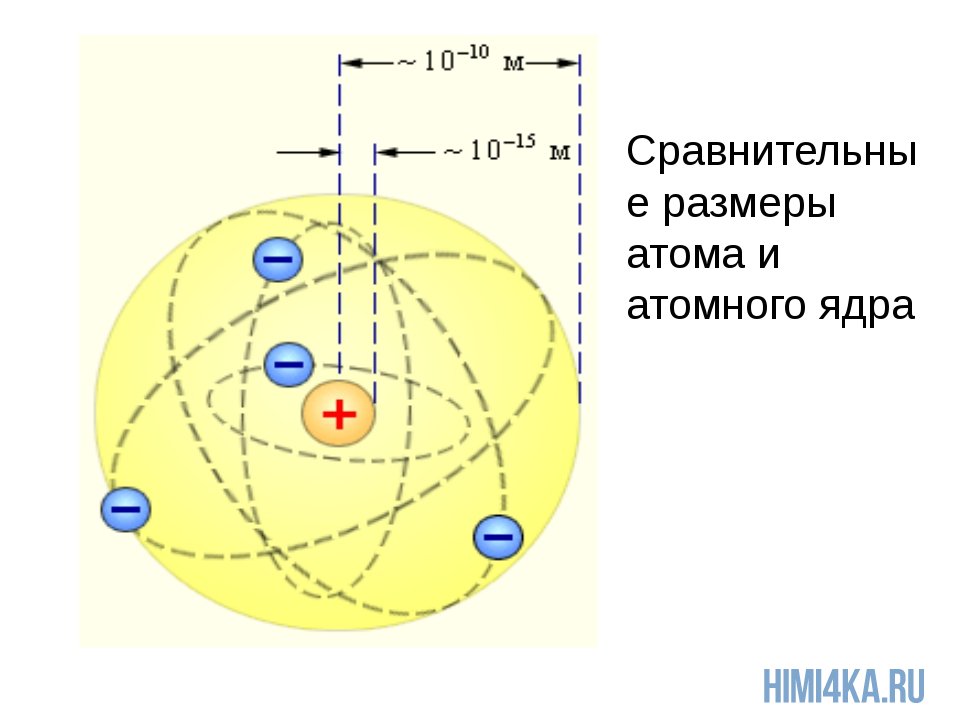
Всем известно, что атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся его масса. Внутри ядра находятся протоны и нейтроны, а вокруг него по орбитам движутся отрицательно заряженные электроны (рис. 1).
Рис. 1. Схематическое изображение строения атома неона.
Впервые модель строения атома была предложена в 1903 году Дж. Дж. Томсоном. Согласно его предположениям, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда.
Гипотеза Томсона была проверена и уточнена Э. Резерфордом, который провел серию опытов по рассеянию α-частиц тонкими металлическими пластинками и сообщил. На основании своего исследования он заключил что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален. Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома – величина порядка 10 -8 см, а диаметр ядра – порядка 10 -13 – 10 -12 см. Такая модель строения атома получила название ядерной.
Однако, несмотря на большой прорыв в изучении строения атома теория Э. Резерфорда не могла дать ответ на два вопроса: устойчивость атома и приводила к неправильным выводам о характере атомных спектров.
Существенный вклад в развитие представлений о строении атома в 1913 году сделал Нильс Бор, предложивший квантовую теорию, объединяющую ядерную модель атома с квантовой теорией света. Он показал, что способность нагретого тела к лучеиспусканию можно описать количественно предположив, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно, т.е. отдельными порциями – квантами.
Основные положения теории Бора о схеме строения атома
Основные положения своей теории Бор изложил в виде постулатов:
- Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам (стационарным).
- Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
- Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.
Однако и теория Н. Бора страдала противоречивостью, например не могла ответить на вопрос: где находится электрон в процессе перехода с одной орбиты на другую.
Эта задача была решена только после развития нового ответвления теоретической физики – квантовой (волновой) механики (учения Луи де Бройля и Шредингера).
Примеры решения задач
| Задание | Относительная атомная масса вольфрама равна 183,2. Известно, что вольфрам состоит из двух изотопов: 183 W и 184 W. Рассчитайте молярную долю каждого изотопа в природном вольфраме. |
| Решение | Изотопы – это атомы одного и того же химического элемента, имеющие разные массовые числа (одинаковое число протонов, но разное – нейтронов). Примем за х число атомов изотопа вольфрама 183 W в каждых ста атомах природного вольфрама, тогда число атомов изотопа 184 W будет равно (100-х). Масса атомов изотопа 183 W будет равна 183х, а 184 W – 184×(100-х). Составим уравнение: |
Значит содержание изотопа 183 W в природном вольфраме равно 80%. Тогда, содержание изотопа 184 W: 100-80 = 20%.
| Задание | Составьте электронные и электронно-графические формулы атомов хлора и марганца. Укажите их сходство и различие. Определите для этих атомов высшую и низшую степени окисления. Напишите формулы высших оксидов этих элементов и соответствующих им гидроксидов. Укажите свойства гидроксидов. |
| Ответ | Хлор: |
Энергетическая диаграмма основного состояния принимает следующий вид:
Энергетическая диаграмма основного состояния принимает следующий вид:
Хлор и марганец имеют одинаковое количество электронов на внешней электронной оболочке – 7, поэтому они находятся в одной группе Периодической таблицы Д.И. Менделеева — VII. Высшая валентность, так же как и степень окисления определяются по номеру группы, следовательно равны VII и +7, соответственно. Низшая валентность для атома хлора равна I, а степень окисления -1; марганца – II и +2, соответственно.
Высшие оксиды имеют формулы Cl2O7 и Mn2O7, а соответствующие им гидроксиды HMnO4 и HClO4, они проявляют кислотные свойства.
Источник статьи: http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/sxema/
Урок 1. Схема строения атомов
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
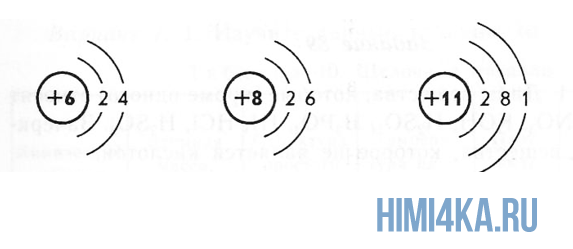
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона
1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала , поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×10 23 а.е.м и наоборот 1 а.е.м. = 1,66×10 -24 г. Число 6,022×10 23 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10 -19 | 1,67·10 -24 | 1,00728 |
| Нейтрон | 0 | 1,67·10 -24 | 1,00866 |
| Электрон | -1,6·10 -19 | 9,10·10 -28 | 0,00055 |
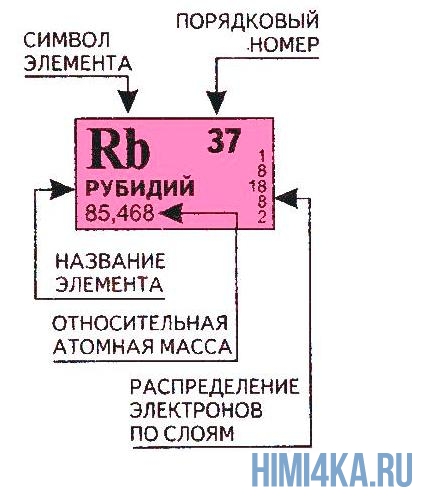
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник статьи: http://himi4ka.ru/arhiv-urokov/urok-1-shema-stroenija-atomov.html
Строение атома
Теме «Строение атома» посвящен первый вопрос ЕГЭ по химии. Это тема, обязательная для изучения. Понимание принципов строения атома — залог понимания химии в дальнейшем. Чтобы помочь максимальному числу выпускников в подготовке к ЕГЭ, я распространяю часть своих материалов и статей бесплатно. Эта статья содержит всю необходимую теорию для решения первого задания ЕГЭ по химии. Подписывайтесь на мой канал и получайте новые качественные материалы бесплатно!
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU . Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook . Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на занятия (индивидуальные, в мини-группах, очно и онлайн) или на онлайн-курс « 40 шагов к 100 баллам на ЕГЭ по химии «.
Тел. для записи на занятия +79778345628, e-mail: ste-vn@ya.ru, профиль Вконтакте.
Темы кодификатора ЕГЭ: Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы. Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов.
Одну из первых моделей строения атома — « пудинговую модель » — разработал Д.Д. Томсон в 1904 году. Томсон открыл существование электронов, за что и получил Нобелевскую премию. Однако наука на тот момент не могла объяснить существование этих самых электронов в пространстве. Томсон предположил, что атом состоит из отрицательных электронов, помещенных в равномерно заряженный положительно «суп», который компенсирует заряд электронов (еще одна аналогия — изюм в пудинге). Модель, конечно, оригинальная, но неверная. Зато модель Томсона стала отличным стартом для дальнейших работ в этой области.
И дальнейшая работа оказалась эффективной. Ученик Томсона, Эрнест Резерфорд, на основании опытов по рассеянию альфа-частиц на золотой фольге предложил новую, планетарную модель строения атома.
Согласно модели Резерфорда, атом состоит из массивного, положительно заряженного ядра и частиц с небольшой массой — электронов, которые, как планеты вокруг Солнца, летают вокруг ядра, и на него не падают.
Модель Резерфорда оказалась следующим шагом в изучении строения атома. Однако современная наука использует более совершенную модель, предложенную Нильсом Бором в 1913 году. На ней мы и остановимся подробнее.
Атом — это мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
При этом электроны двигаются не по определенной орбите, как предполагал Резерфорд, а довольно хаотично. Совокупность электронов, которые двигаются вокруг ядра, называется электронной оболочкой .
Атомное ядро , как доказал Резерфорд — массивное и положительно заряженное, расположено в центральной части атома. Структура ядра довольно сложна, и изучается в ядерной физике. Основные частицы, из которых оно состоит — протоны и нейтроны . Они связаны ядерными силами ( сильное взаимодействие ).
Рассмотрим основные характеристики протонов , нейтронов и электронов :
И — самое главное. Периодическая система химических элементов, структурированная Дмитрием Ивановичем Менделеевым, подчиняется простой и понятной логике: номер атома — это число протонов в ядре этого атома . Причем ни о каких протонах Дмитрий Иванович в XIX веке не слышал. Тем гениальнее его открытие и способности, и научное чутье, которое позволило перешагнуть на полтора столетия вперёд в науке.
Следовательно, заряд ядра Z равен числу протонов , т.е. номеру атома в Периодической системе химических элементов.
Массовое число указано в Периодической системе химических элементов в ячейке каждого элемента.
Обратите внимание! При решении задач ЕГЭ массовое число всех атомов, кроме хлора, округляется до целого по правилам математики. Массовое число атома хлора в ЕГЭ принято считать равным 35,5.
В Периодической системе собраны химические элементы — атомы с одинаковым зарядом ядра. Однако, может ли меняться у этих атомов число остальных частиц? Вполне. Например, атомы с разным числом нейтронов называют изотопами данного химического элемента. У одного и того же элемента может быть несколько изотопов.
Попробуйте ответить на вопросы. Ответы на них — в конце статьи:
- У изотопов одного элемента массовое число одинаковое или разное?
- У изотопов одно элемента число протонов одинаковое или разное?
Химические свойства атомов определяются строением электронной оболочки и зарядом ядра. Таким образом, химические свойства изотопов одного элемента практически не отличаются.
Поскольку атомы одного элемента могут существовать в форме разных изотопов, в названии часто указывается массовое число, например, хлор-35, и принята такая форма записи атомов:
3. Определите количество нейтронов, протонов и электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным ( стационарным ) орбитам , удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни .
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n .
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень . Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2 l +1. На каждой орбитали может находиться не более двух электронов.
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону . Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l . Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n .
Таким образом, энергетический ряд орбиталей выглядит так:
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Электронные формулы элементов первых четырех периодов
Поскольку первый энергетический уровень вмещает максимально 2 электрона, у лития начинается заполнение второго энергетического уровня, начиная с орбитали с минимальной энергией — 2s. При этом сначала заполняется первый энергетический уровень:
Попробуйте составить электронную и электронно-графическую формулы для следующих элементов, а затем можете проверить себя по ответам конце статьи:
От натрия до аргона заполнение 3-го уровня происходит в том же порядке, что и заполнение 2-го энергетического уровня. Предлагаю составить электронные формулы элементов от магния до аргона самостоятельно, проверить по ответам.
А вот начиная с 19-го элемента, калия , иногда начинается путаница — заполняется не 3d-орбиталь, а 4s . Ранее мы упоминали в этой статье, что заполнение энергетических уровней и подуровней электронами происходит по энергетическому ряду орбиталей , а не по порядку. Рекомендую повторить его еще раз. Таким образом, формула калия :
Формулы остальных элементов мы приводить не будем, можете составить их самостоятельно и проверить себя в Интернете.
Основное и возбужденное состояние атома
Электронные формулы, которые мы составляли до этого, соответствуют основному энергетическому состоянию атома . Это наиболее выгодное энергетически состояние атома.
Однако, чтобы образовывать химические связи , атому в большинстве ситуаций необходимо наличие неспаренных (одиночных) электронов . А химические связи энергетически очень для атома выгодны. Следовательно, чем больше в атоме неспаренных электронов — тем больше связей он может образовать, и, как следствие, перейдёт в более выгодное энергетическое состояние.
Поэтому при наличии свободных энергетических орбиталей на данном уровне спаренные пары электронов могут распариваться , и один из электронов спаренной пары может переходить на вакантную орбиталь. Таким образом число неспаренных электронов увеличивается , и атом может образовать больше химических связей , что очень выгодно с точки зрения энергии. Такое состояние атома называют возбуждённым и обозначают звёздочкой.
Например, в основном состоянии бор имеет следующую конфигурацию энергетического уровня:
Попробуйте самостоятельно составить электронную формулу, соответствующую возбуждённому состоянию атомов. Не забываем проверять себя по ответам!
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы .
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы . Например : катион натрия образуется так:
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома . Обратите внимание , при образовании катионов электроны уходят с внешнего энергетического уровня . При образовании анионов электроны приходят на внешний энергетический уровень .
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
- У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома -81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
Источник статьи: http://zen.yandex.ru/media/chemege/stroenie-atoma-5f50c3811a1ddf477673d499