Схемы образования химических элементов
Что такое химический элемент?
Определенный вид атомов называют химическим элементом. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, водород обозначают латинской буквой H – первой буквой латинского названия этого элемента Hydrogenium.
Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в Периодической системе, где все они расположены в определенном порядке.
Главным свойством атома, относящим его к определенному элементу, является заряд ядра
Химические связи
Образование химических веществ происходит с помощью химических связей. Химической связью называют силы, удерживающие атомы в молекулах или кристаллах. Эти силы носят электростатический характер, ядра связанных атомов притягиваются вследствие наличия области повышенной электронной плотности между ними.
Увеличение электронной плотности происходит вследствие перекрывания электронных орбиталей в области связывания, так как расстояние между ядрами связанных атомов меньше, чем сумма радиусов атомов. Межъядерное расстояние принимают за длину химической связи. Образование связи происходит только в том случае, если этот процесс энергетически выгоден, поэтому образование связи всегда сопровождается выделением энергии.
Рис. 1. Образование химической связи.
Энергия химической связи – это то значение энергии (в кДж/моль), которое необходимо затратить для разрыва связи и которое выделяется при ее образовании.
При образовании связей, как правило, достраивается октет (восемь) электронов для связанных атомов, то есть их внешняя электронная оболочка становится завершенный, что и придает стабильность молекуле или кристаллу и делает эту систему равновесной.
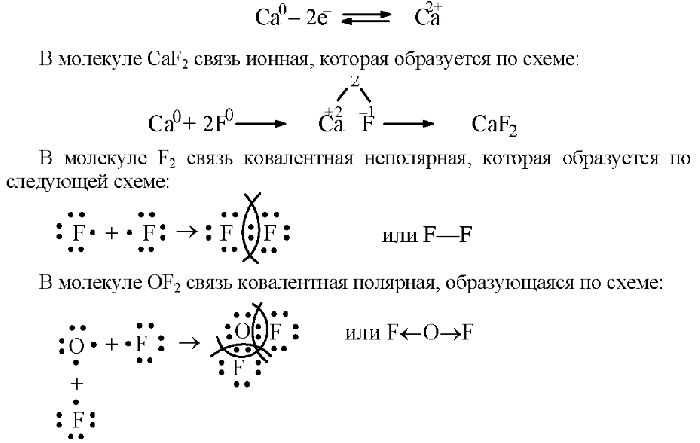
Схемы образования химических элементов бывают атомные или ковалентные (полярные и неполярные), ионные, металлические, водородные:
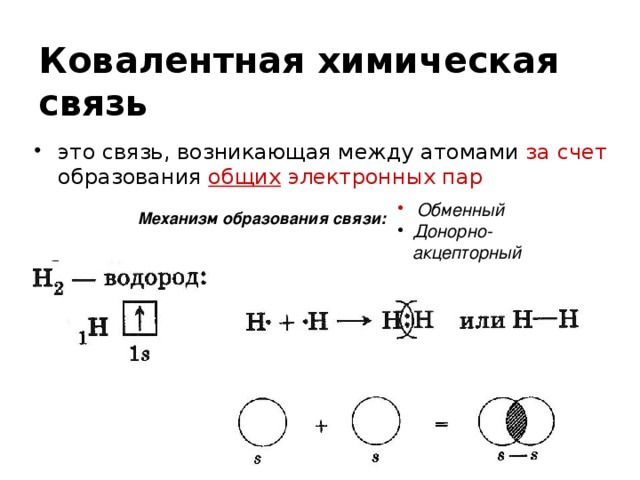
- ковалентная химическая связь – это связь, осуществляемая за счет образования общих электронных пар. Неполярная ковалентная связь образуется между атомами с одинаковой электроотрицательностью. полярная ковалентная связь образуется между атомами, электроотрицательности которых незначительно отличаются.
Рис. 2. Ковалентная химическая связь.
- ионная связь – химическая связь, возникающая между ионами в результате действия электростатических сил притяжения
- металлическая связь – характерна для элементов, атомы которых на внешнем уровне имеют мало валентных электронов, слабо удерживающихся в атоме, и большое количество энергетически близких свободных орбиталей.
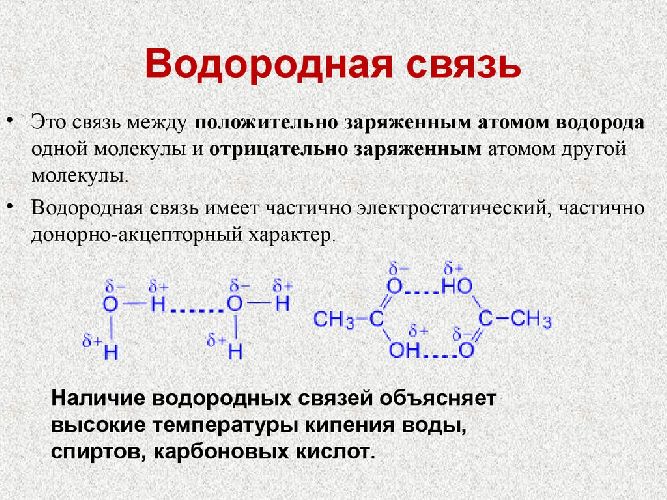
- водородная связь – слабая связь физической природы, которая образуется между молекулами, содержащими электроотрицательные атомы (кислород О, азот N), которые имеют неподеленную электронную пару, и молекулами, в которых атом водорода имеет небольшой положительный заряд.
Рис. 3. Водородная химическая связь.
Что мы узнали?
Химический элемент – вид атомов с одинаковым положительным зарядом ядра. Химические вещества образуются из элементов, которые вступают в химические связи. Эти связи могут быть ковалентными, водородными, ионными, металлическими.
Источник статьи: http://obrazovaka.ru/himiya/shemy-obrazovaniya-himicheskih-elementov.html
Как написать схему образования химической связи
Владельцы сайта
Урок №8 — 9. Виды и механизмы образования химической связи. Характеристики химической связи
Сущность химической связи. Виды химической связи
1. Устойчивым является такое состояние атома, при котором его внешний энергетический уровень завершён до 8 электронов (Н, Не – до 2 электронов).
2. Завершённый внешний уровень имеют атомы VIII A группы.
3. одиночные атомы связанные атомы
Главная причина образования химической связи – выделение энергии и повышение устойчивости системы.
4. Чем меньше запас энергии атома, тем более он устойчив в химическом отношении и его состояние наиболее энергетически выгодное.
5. Пути завершения внешнего уровня атомов:
· образование общих электронных пар
· отдача или присоединение электронов
1. Ионная (∆ЭО > 1,7) – связь, осуществляемая за счёт сил электростатического притяжения ионов (Отдача или присоединение ионов).
2. Ковалентная (∆ЭО = 0 – 1,7) — связь осуществляемая путём образования общих электронных пар.
· неполярная(∆ЭО = 0) – связь между одинаковыми атомами неметаллов.
Свойства ковалентной связи:
1) Длина – межъядерное расстояние
2) Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
по донорно-акцепторному механизму
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в молекуле аммиака NH 3 и четырёхвалентен в ионе аммония NH 4 + (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность – обуславливает форму молекулы в пространстве.
Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей. (см. «гибридизация»)
3. Металлическая – связь за счёт обобществления валентных электронов в кристаллической решётке металла. Это связь в металлах и сплавах (примерно в 3-4 раза слабее одинарной ковалентной)
4. Водородная – связь между атомом водорода и сильноэлекроотрицательным элементом F , O , N , Cl . (примерно 15-20 раз слабее ковалентной)
· внутримолекулярная – белки, полипептиды
· межмолекулярная – вода, спирты, аммиак, аминокислоты и др.
Тестовые задания для закрепления:
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
3. Соединение с ионной связью образуется при взаимодействии
4. В каком ряду все вещества имеют ковалентную полярную связь?
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
6. Ковалентная неполярная связь характерна для
7. Веществом с ковалентной полярной связью является
8. Веществом с ковалентной связью является
9. Вещество с ковалентной неполярной связью имеет формулу
10. Веществами с неполярной ковалентной связью являются
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
12. Ковалентная полярная связь характерна для
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1) ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
16. Водородные связи образуются между молекулами
17. Полярность связи наиболее выражена в молекуле
18. Веществами с неполярной ковалентной связью являются
19. Водородная связь не характерна для вещества
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3) брома 4) йода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) йода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
27. Полярность связи наиболее выражена в молекулах
28. В молекуле какого вещества химические связи наиболее прочные?
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
Урок химии по теме «Химическая связь. Электронная схема образования ковалентной связи»
Презентации к уроку
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- На основании знаний о строении атома начать формирование понятий «химическая связь», «ковалентная связь», «электроотрицательность», «ковалентная полярная и неполярная связь».
- Научить школьников записывать схемы образования ковалентной связи для двухатомных молекул.
- Сформировать понятие о кратности ковалентной связи.
- Разъяснить смысл электронных и структурных формул.
Тип урока: Формирование новых знаний
Вид урока: Мультимедиа урок.
Оборудование: компьютер, проектор, мультимедийные ресурсы, периодическая система химических элементов Д.И.Менделеева.
I. Организационный момент
II.Актуализация знаний
Прежде чем рассматривать механизм ковалентной связи, учитель предлагает повторить с учащимися строение атома и распределение электронов по энергетическим уровням; объяснить на основании строения атома причину химической инертности атомов благородных газов; рассмотреть, что такое завершенный электронный слой. (Презентация 1)
Несколько учащихся на макете составляют электронные формулы (Презентация 4)
III. Изучение нового материала
Основными объектами окружающего нас мира являются атомы и молекулы. Наверняка многие из вас знают, что из атомов и молекул состоят все вещи в мире. Тогда как вы объясните, чем они отличаются? Если бы все атомы были одинаковыми, в мире существовал бы лишь один вид материи.
Вам известно, что в настоящее время, существует более ста разновидностей атомов, которые могут соединяться между собой. Если соединяются несколько атомов одного вида, они образуют простые вещества. Существуют и такие вещества, молекулы которых состоят из двух-трех и более атомов разного вида – их называют сложными. Каждое вещество имеет свое название и обладает уникальными свойствами. Каким же образом атомы соединяются между собой?
Далее обсуждаем, все ли атомы химических элементов соединяются. Нет ли в природе одиночных атомов? Оказывается, есть – это атомы благородных газов.
Электроны в атоме располагаются на энергетических уровнях. Электроны наружного слоя называют валентными. Полностью заполненным энергетическим уровнем обладают элементы VIII А группы – благородные (инертные) газы.
Сравниваем электронное строение атомов благородных газов, выясняем особенность завершенных и устойчивых внешних энергетических уровней:
Чем объяснить устойчивость внешнего восьмиэлектронного уровня? Причина этого заключается в том, что все электроны на внешних энергетических уровнях элементов спарены, то есть уже в атомах связаны попарно.
Поскольку электронная конфигурация благородного газа очень устойчива, то её стремятся достичь и атомы других элементов. Все атомы, объединяясь в молекулы, сделать это могут либо, отдав электроны, либо приняв электроны, либо обобществив свои электроны с электронами других атомов.
Число электронов, необходимых атомам разных химических элементов до завершения внешнего электронного слоя, различно.
Внешние электронные слои атомов других химических элементов могут содержать как спаренные, так и не спаренные электроны.
Предлагаем учащимся подсчитать, сколько электронов не хватает атомам каждого из химических элементов второго периода для завершения внешнего электронного слоя.
Вывод: если в атоме нет непарных электронов и нет возможности для их распаривания, как у инертных газов, они не образуют химической связи и соединений не образуют, потому и инертны. В образовании химической связи участвуют в основном непарные электроны наружного слоя атома. Сущность образования химической связи состоит в спаривании непарных электронов.
Ребята, мы ответили на один вопрос, поставленный в задачу нынешнего урока.
– Что заставляет атомы соединяться друг с другом в молекулы?
А вот как происходит это спаривание, нам предстоит разобраться.
Интересно, например, как осуществляется связь между атомами элементов-неметаллов, которые имеют сходную тенденцию к присоединению электронов? Рассмотрим вначале, как образуется связь между атомами одного и того же химического элемента, например в веществах, имеющих двухатомные молекулы.
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом: обобществив свои внешние электроны, то есть, сделав их общими для обоих атомов.
Когда атомы обобществляют свои электроны, образуется ковалентная связь.
Ковалентная связь – это химическая связь, возникающая в результате образования общей электронной пары между взаимодействующими атомами.
Для наглядности изображения того как образуется ковалентная связь используются электронные формулы. В ней каждый атом обозначается буквенными символами соответствующего элемента, а вокруг этого символа точками обозначают все валентные электроны, в том числе и не участвующие в образовании связи. Одна точка обозначает один электрон.
Например: электронная формула водорода 
электронная формула хлора 
электронная формула кислорода 
электронная формула азота
Для образования связи каждый атом предоставляет в общее пользование по одному электрону. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. При этом образующаяся пара электронов принадлежит одновременно двум атомам.
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
Ядро атома водорода окружено сферическим электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния начинают действовать силы притяжения между ядром одного атома и электроном другого атома, а так же силы отталкивания между ядрами и между электронами
Ковалентная связь бывает двух видов – ковалентная неполярная и ковалентная полярная. Связано такое деление с тем, где именно между ядрами будут располагаться общие электронные пары – ровно посередине или будут смещены в сторону одного из ядер.
Расположение общих электронных пар между ядрами связывающихся атомов зависит от электроотрицательности атома.
Электроотрицательность – это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
У элементов рассчитали значение электроотрицательности и расположили их по возрастанию этого значения в ряд электроотрицательности (приводится не полностью):
Источник статьи: http://urok.1sept.ru/%D1%81%D1%82%D0%B0%D1%82%D1%8C%D0%B8/635810/