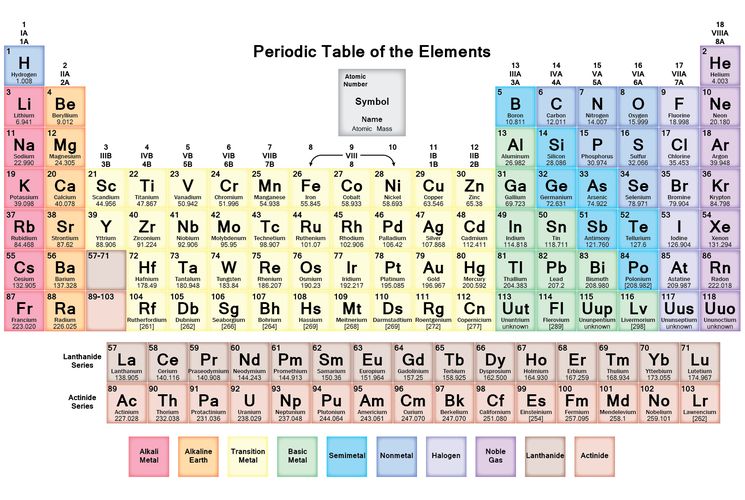
Составляем электронные формулы элементов без всяких расчетов(алгоритмы советской школы).
Здравствуйте, уважаемые читатели!
Обучение школьников составлению электронных формул химических элементов в большинстве случае производится в соответствии со следующим алгоритмом: (https://www.calc.ru/Elektronnaya-Formula-Elementa.html).
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей :
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s2, на втором – максимум 8 (два s и шесть р: 2s22p6), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Как правило, использование этого алгоритма подразумевает распределение электронов по уровням и подуровням с помощью расчетов , т. е на основе постоянного сравнения количества уже учтенных в электронной формуле электронов с общим количеством электронов в атомов. Использование же таблицы Менделеева при этом минимально.
Это можно проследить на множестве обучающих видеоматериалов, в которых авторы обращаются к ТМ практически только за порядковым номером элемента:
или используют ее раскраску:
Проанализировав более 20 видеоматериалов на данную тему, я смогла найти только один, в котором в качестве основы составления формул использовались не расчеты и не искусственные подсказки в виде разной раскраски знаков элементов, а сама структура таблицы Менделеева (10-12 минуты видео):
Преподавание — творческий процесс, каждый преподаватель выбирает те приемы и алгоритмы, которые близки его психологическим характеристикам. Сказывается также и первоначальное знакомство с данным материалом на уроках химии, когда сам преподаватель был школьником.
Ни в коей мере не претендуя на навязывание алгоритмов, по которым работаю, хочу познакомить (или напомнить), как составлять полные и сокращенные электронные формулы с помощью таблицы Менделеева. С данным приемом я познакомилась на уроках моей мамы в далекие советские годы , а затем — на лекциях и семинарах по неорганике в МИТХТ. Об эффективности этого приема может свидетельствовать то, что электронные формулы элементов четырех периодов легко составляли даже те мои одноклассники, которые с трудом могли посчитать молярную массу.
На приведенном ниже видео я попыталась показать, как, используя 2 источника — алгоритм заполнения электронами орбиталей и таблицу Менделеева, можно легко составлять полные и сокращенные электронные формулы любого химического элемента. Заранее прошу прощения за технические и терминологические ляпы (например, «элемент» вместо «атом»), а также за «жаргонные» словечки (вроде «прощелкать по клеткам»). Дело в том, что это видео -мой первый опыт в создании видеоматериалов.
Электронная формула элемента.
Алгоритм составления электронной формулы элемента:
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
Энергетическая диаграмма аргона.
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде:
Источник статьи: http://www.calc.ru/Elektronnaya-Formula-Elementa.html
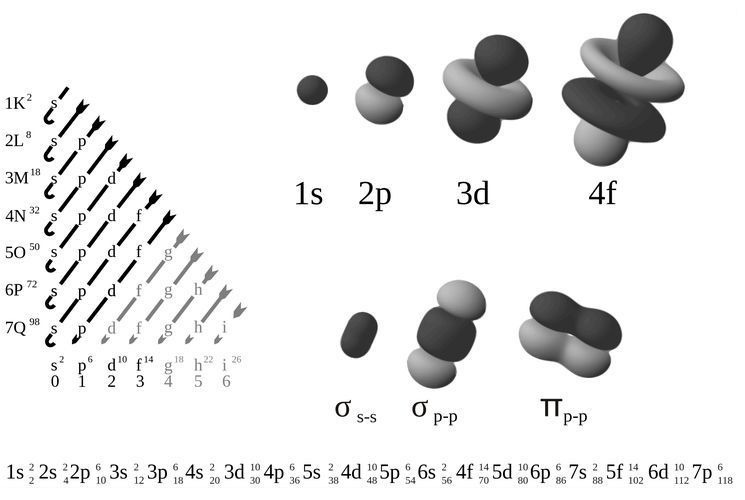
Электронные формулы атомов химических элементов
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s 1
| № | Знак | Элемент | Электронная формула |
| II период | |||
| 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 |
| 5 | B | бор | 1s 2 2s 2 2p 1 |
| 6 | C | углерод | 1s 2 2s 2 2p 2 |
| 7 | N | азот | 1s 2 2s 2 2p 3 |
| 8 | O | кислород | 1s 2 2s 2 2p 4 |
| 9 | F | фтор | 1s 2 2s 2 2p 5 |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 |
| № | Знак | Элемент | Электронная формула |
| III период | |||
| 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 |
| № | Знак | Элемент | Электронная формула |
| IV период | |||
| 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
| № | Знак | Элемент | Электронная формула |
| V период | |||
| 37 | Rb | рубидий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 |
| 38 | Sr | стронций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 |
| 39 | Y | иттрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 1 |
| 40 | Zr | цирконий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2 |
| 41 | Nb | ниобий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 4 |
| 42 | Mo | молибден | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 5 |
| 43 | Tc | технеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5 |
| 44 | Ru | рутений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7 |
| 45 | Rh | родий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 8 |
| 46 | Pd | палладий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 0 4d 10 |
| 47 | Ag | серебро | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 |
| 48 | Cd | кадмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 |
| 49 | In | индий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1 |
| 50 | Sn | олово | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 2 |
| 51 | Sb | сурьма | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 22 4d 10 5p 3 |
| 52 | Te | теллур | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 4 |
| 53 | I | йод | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 5 |
| 54 | Xe | ксенон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 |
| № | Знак | Элемент | Электронная формула |
| VI период | |||
| 55 | Cs | цезий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 |
| 56 | Ba | барий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 |
| 57 | La | лантан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 5d 1 |
| 58 | Ce | церий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 2 |
| 59 | Pr | празеодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 3 |
| 60 | Nd | неодим | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 4 |
| 61 | Pm | прометий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 5 |
| 62 | Sm | самарий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 6 |
| 63 | Eu | европий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 |
| 64 | Gd | гадолиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 7 5d 1 |
| 65 | Tb | тербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 9 |
| 66 | Dy | диспрозий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 10 |
| 67 | Ho | гольмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 11 |
| 68 | Er | эрбий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12 |
| 68 | Tm | тулий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 13 |
| 70 | Yb | иттербий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 |
| 71 | Lu | лютеций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 1 |
| 72 | Hf | гафний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2 |
| 73 | Ta | тантал | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 3 |
| 74 | W | вольфрам | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 4 |
| 75 | Re | рений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 5 |
| 76 | Os | осмий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 6 |
| 77 | Ir | иридий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 7 |
| 78 | Pt | платина | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 9 |
| 79 | Au | золото | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1 4f 14 5d 10 |
| 80 | Hg | ртуть | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 |
| 81 | Tl | таллий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 1 |
| 82 | Pb | свинец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 2 |
| 83 | Bi | висмут | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 3 |
| 84 | Po | полоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 4 |
| 85 | At | астат | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 5 |
| 86 | Rn | радон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 |
| № | Знак | Элемент | Электронная формула |
| VII период | |||
| 87 | Fr | франций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 1 |
| 88 | Ra | радий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 |
| 89 | Ac | актиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 1 |
| 90 | Th | торий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 6d 2 5f 0 |
| 91 | Pa | протактиний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 2 6d 1 |
| 92 | U | уран | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 3 6d 1 |
| 93 | Np | нептуний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 4 6d 1 |
| 94 | Pu | плутоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 5 6d 1 |
| 95 | Am | америций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 |
| 96 | Cm | кюрий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 7 6d 1 |
| 97 | Bk | берклий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 8 6d 1 |
| 98 | Cf | калифорний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 10 |
| 99 | Es | эйнштейний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 11 |
| 100 | Fm | фермий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 12 |
| 101 | Md | менделеевий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 13 |
| 102 | No | нобелий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 |
| 103 | Lr | лоуренсий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 1 |
| 104 | Rf | резерфордий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 2 |
| 105 | Db | дубний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 3 |
| 106 | Sg | сиборгий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 4 |
| 107 | Bh | борий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 5 |
| 108 | Hs | хассий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 6 |
| 109 | Mt | мейтнерий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 7 |
| 110 | Ds | дармштадтий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 8 |
| 111 | Rg | рентгений | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 9 |
| 112 | Cn | коперниций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 |
| 113 | Nh | нихоний | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 1 |
| 114 | Fl | флеровий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 2 |
| 115 | Mс | московий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 3 |
| 116 | Lv | ливерморий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 4 |
| 117 | Ts | теннесcин | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 5 |
| 118 | Og | оганесон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6 |
Электронные конфигурации элементов со 105 по 118
Электронные конфигурации элементов со 105 по 118 приведены согласно данных сайта WebElements
- 105 Db : [Rn].5f 14 .6d 3 .7s 2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2
- 106 Sg : [Rn].5f 14 .6d 4 .7s 2 (догадка, основанная на электронной конфигурации вольфрама) ; 2.8.18.32.32.12.2
- 107 Bh : [Rn].5f 14 .6d 5 .7s 2 (догадка, основанная на электронной конфигурации рения) ; 2.8.18.32.32.13.2
- 108 Hs : [Rn].5f 14 .6d 6 .7s 2 (догадка, основанная на электронной конфигурации осмия) ; 2.8.18.32.32.14.2
- 109 Mt : [Rn].5f 14 .6d 7 .7s 2 (догадка, основанная на электронной конфигурации иридия) ; 2.8.18.32.32.15.2
- 110 Ds : [Rn].5f 14 .6d 9 .7s 1 (догадка, основанная на электронной конфигурации платины) ; 2.8.18.32.32.17.1
- 111 Rg : [Rn].5f 14 .6d 10 .7s 1 (догадка, основанная на электронной конфигурации золота) ; 2.8.18.32.32.18.1
- 112 Cn : [Rn].5f 14 .6d 10 .7s 2 (догадка, основанная на электронной конфигурации ртути) ; 2.8.18.32.32.18.2
- 113 Uut : [Rn].5f 14 .6d 10 .7s 2 .7p 1 (догадка, основанная на электронной конфигурации таллия) ; 2.8.18.32.32.18.3
- 114 Fl : [Rn].5f 14 .6d 10 .7s 2 .7p 2 (догадка, основанная на электронной конфигурации свинца) ; 2.8.18.32.32.18.4
- 115 Uup : [Rn].5f 14 .6d 10 .7s 2 .7p 3 (догадка, основанная на электронной конфигурации висмута) ; 2.8.18.32.32.18.5
- 116 Lv : [Rn].5f 14 .6d 10 .7s 2 .7p 4 (догадка, основанная на электронной конфигурации полония) ; 2.8.18.32.32.18.6
- 117 Uus : [Rn].5f 14 .6d 10 .7s 2 .7p 5 (догадка, основанная на электронной конфигурации астата) ; 2.8.18.32.32.18.7
- 118 Uuo : [Rn].5f 14 .6d 10 .7s 2 .7p 6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Источник статьи: http://www.sciencedebate2008.com/elektronnyye-formuly-atomov/