Формула оксидов.
Формула оксидов необходима для возможности решения задач и понимания возможных вариантов соединений химических элементов. Общая формула оксидов — ЭхОу. Кислород находится на втором месте после фтора по величине значение электроотрицательности, что является причиной того, что большинство соединений химических элементов с кислородом являются оксидами.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
- Основный оксид + сильная кислота → соль + вода: CuO + H2SO4 → CuSO4 + H2O
- Сильноосновный оксид + вода → гидроксид: CaO + H2O → Ca(OH)2
- Сильноосновный оксид + кислотный оксид → соль: CaO + Mn2O7 → Ca(MnO4)2
- Основный оксид + водород → металл + вода: CuO + H2 → Cu + H2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды – оксиды неметаллов и металлов в степени окисления +5 — +7. Могут реагировать с водой, щелочами, основными оксидами, амфотерными оксидами. Элемент кислотного оксида входит в состав аниона образующейся соли. Mn2O7, CrO3, SO3, N2O5.
- Кислотный оксид + вода → кислота: SO3 + H2O → H2SO4. Некоторые оксиды, к примеру SiO2, не могут вступать в реакцию с водой, поэтому их кислоты получают не прямым путём.
- Кислотный оксид + основный оксид → соль: CO2 + CaO → CaCO3
- Кислотный оксид + основание → соль + вода: SO2 + 2NaOH → Na2SO3 + H2O. Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей: Ca(OH)2 + CO2 → CaCO3 ↓ + H2O, CaCO3 + H2O + CO2 → Ca(HCO3)2
- Нелетучий оксид + соль 1 → соль 2 + летучий оксид: SiO2 + Na2CO3 → Na2SiO3 + CO2
- Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1: 2P2O5 + 4HClO4 → 4HPO3 + 2Cl2O7
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
- Na2O – оксид динатрия;
- CO – монооксид углерода;
- СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
Источник статьи: http://www.calc.ru/Formula-Oksidov.html
Высшие оксиды: классификация, формулы и их свойства
Каждый школьник встречался с понятием «оксид» на уроках химии. От одного этого слова предмет начинал казаться чем-то неописуемо страшным. Но ничего страшного здесь нет. Высшие оксиды – это вещества, в которых содержатся соединения простых веществ с кислородом (в степени окисления -2). Стоит отметить, что они реагируют с:
- O2 (кислородом), в том случае, если элемент стоит не в высшей СО. К примеру, SO2 реагирует с кислородом (т. к. СО равна +4), а SO3 — нет (т. к. стоит в наивысшей степени окисления +6).
- H2 (водород) и C (углерод). Вступают в реакцию только некоторые оксиды.
- Водой в том случае, если получается растворимая щелочь или кислота.
Все оксиды вступают в реакцию с солями и неметаллами (за исключением вышеперечисленных веществ).
Стоит отметить, что некоторые вещества (например, оксид азота, оксид железа и оксид хлора) имеют свои особенности, т. е. их химические особенности могут отличаться от других субстанций.
Классификация оксидов
Они делятся на две ветки: те, кто могут образовывать соль, и те, кто образовывать ее не могут.
Примеры формул высших оксидов, которые не образуют солей: NO (окись азота двух валентная; газ без цвета, образующийся во время гроз), CO (угарный газ), N2O (оксид азота одновалентный), SiO (оксид кремния), S2O (оксид серы), вода.
Эти соединения могут реагировать с основаниями, кислотами и солеобразующими оксидами. Но при реагировании этих веществ никогда не образуется солей. Например:
CO (угарный газ) + NaOH (гидроксид натрия) = HCOONa (формиат натрия)
Солеобразующие оксиды делятся на три вида: кислотные, основания и амфотерные окислы.
Кислотные окиси
Кислотный высший оксид – это солеобразующий оксид, который соответствует кислоте. Например, у оксида серы шестивалентного (SO3) есть соответствующее ему химическое соединения – H2SO4. Эти элементы вступают в реакцию с оксидами основных и амфотерных свойств, основаниями и водой. Образуется соль или кислота.
- Со щелочными оксидами: CO2 (углекислый газ) + MgO (окись магния) = MgCO3 (горькая соль).
- С амфотерными окисями: P2О5 (окисел фосфора)+ Al2О3 (окисел алюминия) = 2AlPO4 (фосфат или ортофосфат алюминия).
- С основаниями (щелочами): CO2 (углекислый газ) + 2NaOH (едкий натр) = Na2CO3 (карбонат натрия или кальцинированная сода) + H2O (вода).
- С водой: CO2 (углекислый газ) + H2O = H2CO3 (угольная кислота, после реакции мгновенно распадается на углекислый газ и воду).
Оксиды кислот не вступают в реакцию друг с другом.
Основные оксиды
Основный высший оксид – это солеобразующий окисел металла, которому соответствует основание. Окислу кальция (CaO) соответствует гидроксид кальция (Ca(OH)2). Эти вещества взаимодействуют с окислами кислотного и амфотерного характера, кислотами (за исключением H2SiO3, так как кремниевая кислота нерастворимая) и водой.
- С кислотными оксидами: CaO (оксид кальция) + CO2 (углекислый газ) = CaCO3 (карбонат кальция или обычный мел).
- С амфотерной окисью: CaO (оксид кальция) + Al2O3 (окись алюминия) = Ca(AlO2)2 (алюминат кальция).
- С кислотами: CaO (окисел кальция) + H2SO4 (серная кислота) = CaSO4 (сульфат кальция или гипс) + H2O .
- С водой: CaO (оксид кальция) + H2O = Ca(OH)2 (гидроксид кальция или реакция гашения извести).
Не взаимодействуют между собой.
Амфотерные окиси
Амфотерный высший оксид – это окисел амфотерного металла. В зависимости от условий, он может проявить основные или кислотные свойства. Например, формулы высших оксидов, которые проявляют амфотерные свойства: ZnO (окисел цинка), Al2O3 (глинозем). Реагируют амфотерные окиси со щелочами, кислотами (так же за исключением кремниевой кислоты), основными и кислотными оксидами.
- С основаниями: ZnO (окисел цинка) + 2NaOH (основание натрия) = Na2ZnO2 (двойная соль цинка и натрия)+ H2O.
- С кислотами: Al2O3 (алюминия оксид) + 6HCl (соляная кислота) = 2AlCl3 (хлорид алюминия или хлористый алюминий) + 3H2O.
- С кислотными оксидами: Al2O3 (окисел алюминия) + 3SO3 (окисел серы шестивалентный) = Al2(SO4)3 (алюминиевые квасцы).
- С окислами основного характера: Al2O3 (окисел алюминия) + Na2O (окись натрия) = 2NaAlO2 (алюминат натрия).
Элементы высших оксидов амфотерного характера не взаимодействуют между собой и с водой.
Источник статьи: http://fb.ru/article/409697/vyisshie-oksidyi-klassifikatsiya-formulyi-i-ih-svoystva
Как написать формулу высшего оксида
Порядок составления формул оксидов
Формулы оксидов можно составлять по правилу креста:

Далее необходимо:
1. расставить степени окисления (с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2 (минус два) .
2 . Для того чтобы правильно определить степень окисления. второго элемента необходимо познакомится с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
Степень окисления «0» — ноль имеют:
1. Простые вещества: Н2, Са, О2 …
2. Сложные в-ва (в сумме): Са +2 О -2 (+2 – 2 =0)
Степень окисления со знаком + характерна для элементов которые отдают свои электроны в соединениях другим атомам или от которых оттянуты общие электронные пары, т.е.атомы менее электроотрицательных элементов. например металлы всегда имеют положительную степени окисления.
Подсказка : Узнать степени окисления для металлов можно в таблице «растворимости. » . В ней представлены заряды ионов металлов они обычно совпадают со степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее электроотрицательный, чем сам кислород см. таблицу электроотрицательности.

Составим формулу оксида натрия :
По таблице растворимости заряд иона натрия + , соответственно степень окисления натрия имеет значение +1 ( Na +1 ), с.о. кислорода в оксидах всегда -2.
Натрий имеет положительный заряд, значит, его ставим первым, а вторым ставим кислород и по правилу креста получим: Na 2 +1 O -2 или Na2O .
Правило наименьшего общего кратного это способ наиболее универсальный для составления формул. Как им пользоваться рассмотрим на примере.
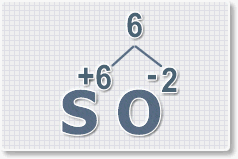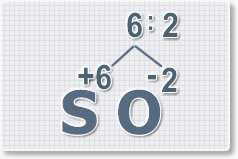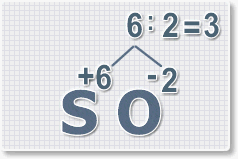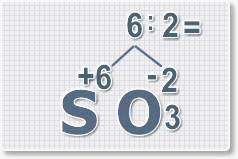
Составить формулу оксида серы (VI) .
1. У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а первым элементом будет сера ее с.о. указана в названии оксида VI, т. е +6. S +6 O -2 .
2. Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6.
3. Находим индексы и расставляем для каждого элемента. См. рисунки ниже.
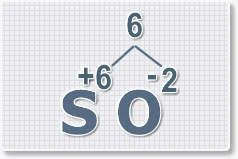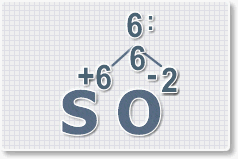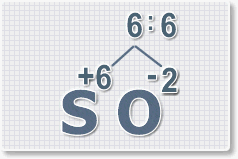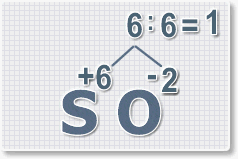
6 : 6 = 1 это индекс для серы. Индексы со значением 1 в формулах не ставятся.
6 : 2 = 3 это индекс для кислорода
В результате получим формулу оксида серы (VI):
Источник статьи: http://osievskaja.narod.ru/klass/oksid/oksid_formula.html
Лабораторный опыт №2. Моделирование построения Периодической системы Д. И. Менделеева.
Смоделируйте построение Периодической системы Д. И. Менделеева. Для этого подготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20-й. На каждой карточке укажите следующие сведения об элементе: химический символ, название, относительную атомную массу, формулу высшего оксида, гидроксида (в скобках укажите их характер – основный, кислотный или амфотерный), формулу летучего водородного соединения (для неметаллов).
Перемешайте карточки, а затем расположите их в ряд по возрастанию относительных атомных масс элементов. Сходные элементы с 1-го по 18-й расположите друг под другом: водород над литием и калий под натрием, соответственно, кальций под магнием, гелий под неоном. Сформулируйте выявленную вами закономерность в виде закона. Обратите внимание на несоответствие относительных атомных масс аргона и калия их расположению по общности свойств элементов. Объясните причину этого явления.
| Химический символ | Название | Относительная атомная масса | Формула высшего оксида | Формула высшего гидроксида | Формула летучего водородного соединения |
|---|---|---|---|---|---|
| H | Водород | 1 | H2O | H2O | |
| He | Гелий | 4 | |||
| Li | Литий | 7 | Li2O (основный) | LiOH (основный) | |
| Be | Бериллий | 9 | BeO (амфотерный) | Be(OH)2 (амфотерный) | |
| B | Бор | 11 | B2O3 (кислотный) | H3BO3 (кислотный) | BH3 |
| C | Углерод | 12 | CO2 (кислотный) | H2CO3 (кислотный) | CH4 |
| N | Азот | 14 | N2O5 (кислотный) | HNO3 (кислотный) | NH3 |
| O | Кислород | 16 | H2O | ||
| F | Фтор | 19 | HF | ||
| Ne | Неон | 20 | |||
| Na | Натрий | 23 | Na2O (основный) | NaOH (основный) | |
| Mg | Магний | 24 | MgO (основный) | Mg(OH)2 (основный) | |
| Al | Алюминий | 27 | Al2O3 (амфотерный) | Al(OH)3 (амфотерный) | |
| Si | Кремний | 28 | SiO2 (кислотный) | H2SiO3 (кислотный) | SiH4 |
| P | Фосфор | 31 | P2O5 (кислотный) | H3PO4 (кислотный) | PH3 |
| S | Сера | 32 | SO3 (кислотный) | H2SO4 (кислотный) | H2S |
| Cl | Хлор | 35.5 | Cl2O7 (кислотный) | HClO4 (кислотный) | HCl |
| Ar | Аргон | 40 | |||
| K | Калий | 39 | K2O (основный) | KOH (основный) | |
| Ca | Кальций | 40 | CaO (основный) | Ca(OH)2 (основный) |
Объяснение несоответствия относительных атомных масс аргона и калия.
Относительные атомные массы химических элементов это средние значения атомных масс изотопов элемента с учетом их долей содержания в природе.
Содержание в природе изотопа 39 K значительно больше, чем изотопа 40 K, поэтому среднее значение относительной атомной массы калия приближается к 39.
Содержание в природе изотопа 40 Ar значительно больше, чем изотопа 39 Ar, поэтому среднее значение относительной атомной массы аргона приближается к 40.
Калий является щелочным металлом, а аргон – инертным газом, поэтому аргон был расположен перед калием, т. е. в VIIIА группе, а калий – в IА группе.
Источник статьи: http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/lab/2.html