§ 40. Оксиды
1. Какие вещества называют оксидами и как их классифицируют? Начертите в тетрадях таблицу и в соответствующих графах запишите перечисленные ниже формулы оксидов: Na2O, N2O5, SiO2, CaO, CrO, CrO3, CuO, Mn2O7, FeO, SO2. Дайте оксидам названия.
Оксидами — соединения из двух элементов, один из которых кислород со степенью окисления -2.
Если степень окисления кислорода -1 это пероксиды.
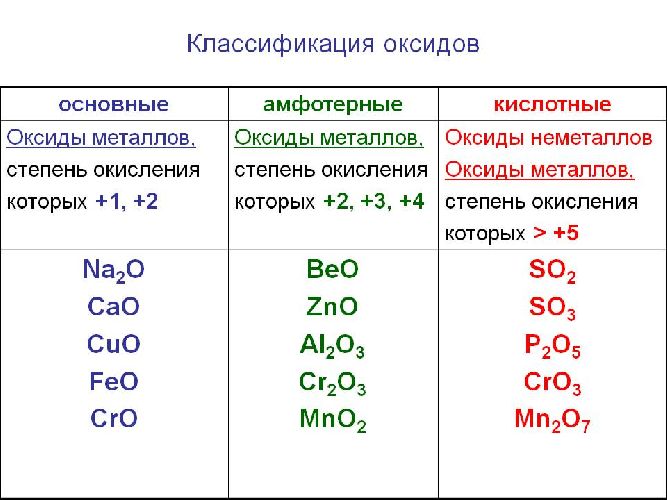
Оксиды классифицируют в зависимости от того, соответствуют они основанию или кислоте. Различают основные, кислотные и амфотерные оксиды.
| Кислотные оксиды | Основные оксиды |
|---|---|
| N2O5 — оксид азота (V) | Na2O — оксид натрия |
| SiO2 — оксид кремния | CaO — оксид кальция |
| CrO3 — оксид хрома (VI) | CrO — оксид хрома (II) |
| Mn2O7 — оксид марганца (VII) | CuO — оксид меди (II) |
| SO2 — оксид серы (IV) | FeO — оксид железа (II) |
2. Составьте уравнения реакций, схемы которых даны ниже:
| а) Li + … → Li2O | е) Li2O + … → LiNO3 + H2O |
| б) Ca + … → CaO | ж) CuO + … → CuCl2 + H2O |
| в) C + … → CO2 | 3) Li2O + … → LiOH |
| г) Al + … → Al2O3 | и) P2O5 + … → H3PO4 |
| д) PH3 + … → P2O5 + H2O | к) SO3 + … → Na2SO4 + … |
Такая задача решается в уме, но человеком подготовленным.
Степень окисления элемента и его валентность в кислоте/основании всегда равна степени окисления элемента и его валентности в соответсвующем оксиде.
Еще кое-что: формулу оксида можно получить, если вычесть из формулы кислоты/основания воду — H2O.
Давайте на примерах:
в H2SO4 степень окисления S = +6 (если не понимаете почему: кислород = -2*4, водород +1*2, а молекула в целом имеет заряд 0).
Значит, в оксиде серы степень окисления также будет +6. Формула — SO3.
В сернистой кислоте H2SO3 валентность S = 4, значит в оксиде серы валентность будет также равна 4. Отсюда формула оксида — SO2.
Другой пример:
вычтем из формулы кислоты воду H2CO3 — H2O = CO2.
5. Перечислите некоторые отрасли экономики, в которых применяются оксиды. Приведите примеры.
Металлургия: получения железа (стали и чугуна) из оксидов железа Fe2O3 и Fe3O4
Строительство: получение гашеной извести Ca(OH)2 из негашеной извести CaO.
Производство стекла: применяют оксид кремния (IV) — SiO2.
Химическая промышленность: получение серной кислоты из оксида серы SO3.
Производство красок: в качестве компонентов белой краски используют ZnO, TiO2.
В быту: вода это тоже оксид — H2O.
6. Выведите химическую формулу оксида, если известно, что натрий с кислородом соединяется в массовом отношении 2,3 : 0,8.
m (Na) : m (O) = x * Ar (Na) : y * Ar (O), где x и y — некоторые коэффициенты, показывающие соотношение количества атомов элементов в соединении.
2,3 : 0,8 = 23x : 16y
Или,
2,3 : 23x = 0,8y : 16
0,1x = 0,05y
x = 0,5y
Разумеется, y не может быть меньше единицы. Значит, x = 2, y = 1. А формула оксида Na2O.
Ответ: формула оксида Na2O
7. Напишите уравнение реакции оксида фосфора (V) с избытком воды и вычислите соотношение масс элементов в реагирующих веществах.
Для P2O5:
P : O = 2 * Ar (P) : 5 * Ar (O) = 2*31 : 5*16 = 62 : 80 = 31 : 40
Для H2O:
H : O = 2 * Ar (H) : 1 * Ar (O) = 2*1 : 16 = 1 : 8
Тестовые задания
4. Из приведенных уравнений химических реакций выберите уравнение, которое не характеризует свойство кислотных оксидов
1) SO3 + H2O = H2SO4
2) SO3 + Na2O = Na2SO4
3) SO3 + 2NaOH = Na2SO4 + H2O
4) H2SO4 = SO3 + H2O
Ответ: 4.
В данном пункте речь идет о кислоте, а не о кислотном оксиде. Вопрос с подвохом 😉
5. Установите соответствие между формулой оксида и формулой соответствующего ему основания или кислоты.
| 1) Na2O | А. H2SO4 |
| 2) SO3 | Б. H2CO3 |
| 3) BaO | В. NaOH |
| 4) CO2 | Г. Ba(OH)2 |
| Д. H2SO3 |
Ответы: 1 — В, 2 — А, 3 — Г, 4 — Б.
Лишний пункт Д сернистой кислоты H2SO3 должен соответствовать оксиду серы SO2.
Источник статьи: http://himgdz.ru/gdz-rudzitis-8-40/
Формула оксидов.
Формула оксидов необходима для возможности решения задач и понимания возможных вариантов соединений химических элементов. Общая формула оксидов — ЭхОу. Кислород находится на втором месте после фтора по величине значение электроотрицательности, что является причиной того, что большинство соединений химических элементов с кислородом являются оксидами.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
- Основный оксид + сильная кислота → соль + вода: CuO + H2SO4 → CuSO4 + H2O
- Сильноосновный оксид + вода → гидроксид: CaO + H2O → Ca(OH)2
- Сильноосновный оксид + кислотный оксид → соль: CaO + Mn2O7 → Ca(MnO4)2
- Основный оксид + водород → металл + вода: CuO + H2 → Cu + H2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды – оксиды неметаллов и металлов в степени окисления +5 — +7. Могут реагировать с водой, щелочами, основными оксидами, амфотерными оксидами. Элемент кислотного оксида входит в состав аниона образующейся соли. Mn2O7, CrO3, SO3, N2O5.
- Кислотный оксид + вода → кислота: SO3 + H2O → H2SO4. Некоторые оксиды, к примеру SiO2, не могут вступать в реакцию с водой, поэтому их кислоты получают не прямым путём.
- Кислотный оксид + основный оксид → соль: CO2 + CaO → CaCO3
- Кислотный оксид + основание → соль + вода: SO2 + 2NaOH → Na2SO3 + H2O. Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей: Ca(OH)2 + CO2 → CaCO3 ↓ + H2O, CaCO3 + H2O + CO2 → Ca(HCO3)2
- Нелетучий оксид + соль 1 → соль 2 + летучий оксид: SiO2 + Na2CO3 → Na2SiO3 + CO2
- Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1: 2P2O5 + 4HClO4 → 4HPO3 + 2Cl2O7
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
- Na2O – оксид динатрия;
- CO – монооксид углерода;
- СО2 – диоксид углерода.
Часто используются также тривиальные названия некоторых оксидов:
Источник статьи: http://www.calc.ru/Formula-Oksidov.html
Кислотные оксиды
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
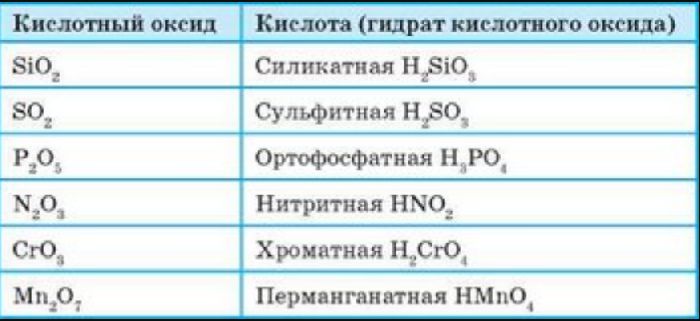
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Источник статьи: http://obrazovaka.ru/himiya/kislotnye-oksidy-spisok-primery.html
Как написать формулу оксидов для соответствующим им гидроксидов?
Вот парочка примеров а дальше всё равно почитайте
ClO2 — кислотный оксид
2 ClO2 + H2O —> HClO2 + HClO3
2 ClO2 + 2 KOH —> KClO2 + KClO3
Ba(OH)2
ВаО — основной оксид
BaO + H2O —> Ba(OH)2
BaO + 2 HCl —> BaCl2 + H2O
BaO + CO2 —> BaCO3
Оксиды – соединения атомов двух элементов, один из которых кислород в степени окисления –2.
В оксидах атомы кислорода связаны только с атомами другого элемента и не связаны друг с другом. Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (–О–О–), называют пероксидами.
Не образуют оксидов только Hе, Ne, Аr и F. Различают высшие оксиды, в которых атом элемента проявляет высшую степень окисления (обычно равна номеру группы, в которой находится элемент) , и низшие оксиды – те, в которых атом элемента проявляет низшую степень окисления. Оксиды, содержащие атомы элемента в разных степенях окисления, называют двойными, например:
Fe3O4 FeO•Fe2O3, Mn3O4 MnO•Mn2O3, Pb2O3 PbO•PbO2.
По химическим свойствам оксиды делятся на солеобразующие (образуют соли при взаимодействии с кислотами и/или щелочами) и несолеобразующие (не образуют солей, безразличны к кислотам и щелочам; к ним относятся СO, NO, N2O, SiO, S2O).
Многие солеобразующие оксиды присоединяют воду. Этот процесс называется гидратацией, а его продукты – гидратами оксидов, или гидроксидами (содержат одну или несколько гидроксигрупп –ОН) .
Некоторые оксиды с водой не взаимодействуют, их гидроксиды можно получить косвенным путем.
Оксид и гидроксид соответствуют друг другу, если содержат один и тот же элемент с одной и той же степенью окисления атома.
Солеобразующие оксиды разделяют на основные, кислотные и амфотерные в зависимости от типа соответствующего гидроксида. Kислотно-основные свойства родственных оксидов и гидроксидов (Na2O и NaOH, SO3 и H2SO4) cовпадают.
Основными называют оксиды, которым соответствуют гидроксиды – основания.
Kислотными называют оксиды, которым соответствуют гидроксиды – кислоты.
Амфотерными называют оксиды, которым соответствуют амфотерные гидроксиды.
Неметаллы образуют только кислотные и несолеобразующие оксиды; металлы образуют все основные, все амфотерные и некоторые кислотные оксиды. Многие металлы побочных подгрупп, имеющие в соединениях переменную с. о. атомов, могут образовывать несколько оксидов и гидроксидов, характер которых зависит от с. о. атома элемента. С ростом степени окисления атома элемента его электроотрицательность растет. Соответственно растут неметаллические свойства элемента, а также кислотные свойства его оксида и гидроксида.
Оксиды металлов в с. о. атомов +1 (Na2O, K2O и др.) , а также большинство оксидов металлов в с. о. атомов +2 (FeO, MgO и др. ) являются основными. Исключения: BeO, ZnO, PbO, SnO – амфотерные. Большинство оксидов металлов в с. о. атомов +3 и +4 – амфотерные (Al2O3, Cr2O3, Fe2O3, SnO2, PbO2 и др.) . Оксиды металлов в с. о. атомов +5, +6, +7, +8 – кислотные (Mn2O7, CrO3, Sb2O5 и др. )
Посмотрите схему
Источник статьи: http://otvet.mail.ru/question/36544865