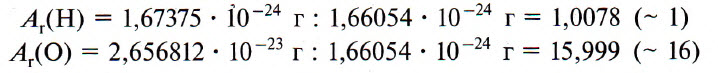Относительная атомная масса химических элементов
Размеры и массы молекул очень малы. Размеры и массы атомов ещё меньше. Масса самого лёгкого атома — атома водорода равна 1,67375 ⋅ 10−24 г, масса атома кислорода — 2,656812 ⋅ 10−23 г, а масса атома углерода — 1,9927 ⋅ 10−23 г. Производить расчёты с такими числами неудобно. Поэтому для измерения масс атомов и молекул была введена атомная единица массы (а. е. м.).
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а. е. м.
На Земле встречаются три разновидности атомов углерода, различающиеся массой. Такие разновидности атомов одного и того же элемента называют изотопами . В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают A r.
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
А r(Н) = 1,67375 ⋅ 10−24 г : 1,66054 ⋅ 10−24 г = 1,0078 (
А r(О) = 2,656812 ⋅ 10−23 г : 1,66054 ⋅ 10−24 г = 15,999 (
- ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА элемента ( А r) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г. В память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da).
Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.В прикреплённой таблице написаны относительные атомные массы некоторых химических элементов:
Источник статьи: http://zen.yandex.ru/media/id/5ea18ca322b6bd32eecb4f38/otnositelnaia-atomnaia-massa-himicheskih-elementov-5eb2fea7a3f457144fc03e5d
Относительная атомная масса
Важной характеристикой отдельно взятого атома является его масса . Масса атома складывается из масс входящих в его состав протонов, нейтронов и электронов с учётом дефекта массы . Массой электронов в расчётах можно пренебрегать, так как она несоизмеримо мала по сравнению с массами покоя протона и нейтрона. Поэтому, вполне можно пользоваться понятием масса нуклида .
Напомним, что нуклид — это ядро атома с конкретным числом протонов и нейтронов.
Дефект массы – потеря ядром атома части массы при его синтезе из отдельных протонов и нейтронов.
Данная формула свидетельствует, что при ядерном синтезе ядро теряет часть массы с выделяющейся энергией. Поэтому масса ядра атома всегда меньше суммы масс покоя входящих в состав ядра протонов и нейтронов.
Разность между суммой масс покоя нуклонов (протонов и нейтронов), входящих в состав ядра и массой ядра и есть дефект массы .
Масса нуклида выраженная в килограммах называется абсолютной массой нуклида .
Во многих учебниках можно встретить информацию о том, что в расчётах величиной абсолютной массы, якобы, пользоваться не удобно, поэтому вводят величину относительной атомный массы. Но это заблуждение. Причина использования относительной атомной массы совершенно другая. Корни её кроются в истории.
Абсолютная масса очень маленькая величина. Для химиков и физиков 16-17 веков экспериментально её измерить было невозможно. Но даже в то время было важно проводить химические расчёты.
Первым учёным, решившим эту проблему, был Джон Дальтон, он предложил ввести величину относительной атомной массы (Аr) . Относительной она называется потому, что вычисляется по отношению к массе произвольно выбранного эталона. Дальтон выбрал за эталон массу самого лёгкого атома — атома водорода и, принял её равной 1.
Относительные атомные массы известных на то время элементов рассчитывались Дальтоном на основе открытым им закона кратных отношений.
В настоящее время за эталон выбрана 1/12 часть абсолютной массы нуклида 12С. Этот эталон принято называть атомной единицей массы , сокращённо а.е.м.
Источник статьи: http://zen.yandex.ru/media/disttutor/otnositelnaia-atomnaia-massa-5d72391380879d00ac1c2190
Почему атомная масса в таблице Менделеева относительна?
В предыдущей серии мы рассчитали среднюю атомную массу хлора, значение, которое мы можем наблюдать в таблице Менделеева, и обозначили её как Ar ,что означает — Relative atomic mass, то есть, относительная атомная масса.
Почему в химии люди вынуждены оперировать относительными атомными массами и что скрывается за данным понятием? Попробуем разобраться.
Дело в том, что масса атома сама по себе крайне мала, так масса наиболее распространённого изотопа углерода C (12) равна 1,992*10^-23 грамма. То есть, ноль целых, затем идут двадцать три ноля, и лишь после этого получаем значащие после запятой цифры. Оперировать такими маленькими значениями очень неудобно, поэтому химики искали решение данной проблемы, решим её и мы.
Из чего состоит изотоп углерода С (12):
- Из 6 протонов (порядковый номер углерода в таблице Менделеева равен 6)
- 6 электронов ( атом электронейтрален )
- и 6 нейтронов (разница между атомной массой в таблице и порядковым номером).
Среди перечисленных частиц хоть сколько-нибудь значительной массой обладают лишь протоны и нейтроны (массы протона и нейтрона отличаются друг от друга, однако совсем незначительно), чьи массы равны: m (p+) = m (n)
Это значит, что мы можем при небольшом допущении принять так называемую атомную единицу массы (а.е.м.), если поделим массу изотопа углерода C (12) на 12 (сумма числа протонов и нейтронов):
причём данное значение (а.е.м.) будет примерно равно как массе протона, так и массе нейтрона: а.е.м = m (p+) = m (n)
Далее перейдём к водороду.
Атом водорода состоит из одного протона и одного электрона. Напомню, что масса электрона пренебрежимо мала. Это значит, что масса атома водорода примерно равна массе протона, то есть m (H) = m (p+) , а масса протона в свою очередь примерно равна значению а.е.м:
То есть, если мы поделим массу атома водорода на значение а.е.м., то получим 1! Что довольно-таки удобно.
Вот мы и подобрались к понятию относительной атомной массы Ar
Атомная масса — Ar в таблице Менделеева относительна, ведь является отношением реальной массы атома к значению а.е.м. ,что делает эту величину, во-первых, безразмерной (ведь при её рассчёте граммы делятся на граммы), а во вторых при некотором пренебрежении целочисленной , что очень удобно!
На этом наша четвёртая часть подошла к концу, и, если с атомной массой, протонами и нейтронами мы более менее разобрались, то в следующей серии поговорим об электронной оболочке!
Источник статьи: http://zen.yandex.ru/media/id/5e6da78c15b53f03073e4f88/pochemu-atomnaia-massa-v-tablice-mendeleeva-otnositelna-5e6e194853be0d0a19b23f22
Как написать атомную массу
Химический язык и его части
Человечество использует много разных языков. Кроме естественных языков (японского, английского, русского – всего более 2,5 тысяч), существуют еще и искусственные языки, например, эсперанто. Среди искусственных языков выделяются языки различных наук. Так, в химии используется свой, химический язык. Химический язык – система условных обозначений и понятий, предназначенная для краткой, ёмкой и наглядной записи и передачи химической информации. Сообщение, написанное на большинстве естественных языков, делится на предложения, предложения – на слова, а слова – на буквы. Если предложения, слова и буквы мы назовем частями языка, то тогда мы сможем выделить аналогичные части и в химическом языке (таблица 1).
Таблица 1. Части химического языка
Информация об атомах и химических элементах
(» буквы» химического языка)
Информация о химических веществах
(«слова» химического языка)
Информация о химических реакциях («предложения» химического языка)
СИМВОЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
СХЕМЫ И УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые » буквы» , научитесь понимать смысл » слов» и» предложений» . Вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
Химические знаки (символы химические) — буквенные обозначения химических элементов. Состоят из первой или из первой и одной из следующих букв латинского названия элемента,напр., углерод — С (Carboeum), кальций — Ca (Calcium), кадмий — Cd…
Символ химического элемента – условное обозначение химического элемента.
Историческая справка: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца ( ☉ , золото), Луны ( ☽ , серебро), Юпитера ( ♃ , олово),Венеры (♀, медь), Сатурна ( ♄ , свинец), Меркурия ( ☿ , ртуть),Марса ( ♁ , железо). Металлы, открытые в XV—XVIII веках, — висмут, цинк,кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака водыÑ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Попытки упорядочить старинные химические знаки продолжались до конца XVIIIвека. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824московский врач И. Я. Зацепин.
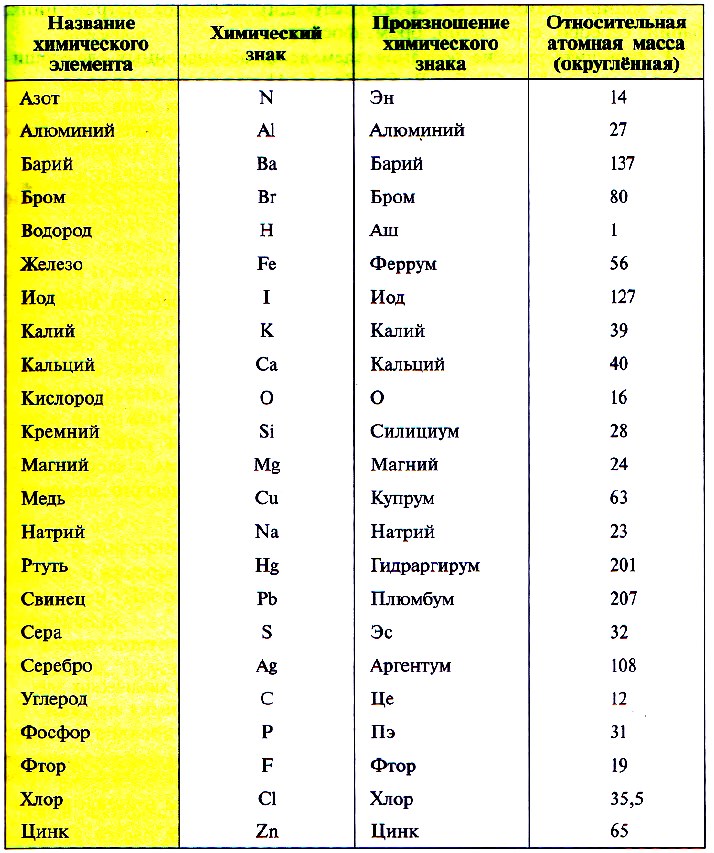
Ниже приведена таблица химических знаков некоторых элементов, их названия , относительные массы и произношение.
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Историческая справка: Английский ученый Джон Дальтон (1766–1844) на своих лекциях демонстрировал студентам выточенные из дерева модели атомов, показывая, как они могут соединяться, образуя различные вещества. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это раскрашенные в разные цвета деревянные кубики, которые изобрел мистер Дальтон».
Конечно, Дальтон прославился не своими «кубиками» и даже не тем, что в двенадцатилетнем возрасте стал школьным учителем. С именем Дальтона связано возникновение современной атомистической теории. Впервые в истории науки он задумался о возможности измерения масс атомов и предложил для этого конкретные способы. Понятно, что непосредственно взвесить атомы невозможно. Дальтон рассуждал только о «соотношении весов мельчайших частиц газообразных и других тел», то есть об относительных их массах. И поныне, хотя масса любого атома в точности известна, ее никогда не выражают в граммах, так как это исключительно неудобно. Например, масса атома урана – самого тяжелого из существующих на Земле элементов – составляет всего 3,952·10 –22 г. Поэтому массу атомов выражают в относительных единицах, показывающих, во сколько раз масса атомов данного элемента больше массы атомов другого элемента, принятого в качестве стандарта. Фактически это и есть «соотношение весов» по Дальтону, т.е. относительная атомная масса.
Абсолютные массы некоторых атомов:
· В настоящее время в физике и химии принята единая система измерения.
Введена атомная единица массы (а.е.м.)
= 1,67375 ∙ 10 -24 г/1,66057 ∙ 10 -24 г = 1,0079 а.е.м.
· Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12 С, это безразмерная величина.
Относительная атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина
Например, относительная атомная масса атома кислорода равна 15,994 (используем значение из периодической системы химических элементов Д. И. Менделеева).
Записать это следует так, Ar(O) = 16. Всегда используем округлённое значение, исключение представляет относительная атомная масса атома хлора:
·Связь между абсолютной и относительной массами атома представлена формулой:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
Используя ПСХЭ составьте пары из знаков химических элементов и соответствующих русских названий:
- N, Ar, P, Al, S, Mg, Cr
- Алюминий, сера, азот, хром, фосфор, аргон, магний
Используя ПСХЭ определите относительные атомные массы химических элементов с порядковыми номерами: 80, 23, 9, 2
Дайте характеристикухимическому элементу – О по его положению в ПСХЭ согласно плану:
- Название русское
- Порядковый номер
- Произношение
- Значение относительной атомной массы
№4.
Разгадайте новое слово,которое можно получить, если от начала или конца названия химического элемента убрать число букв, соответствующее числу точек.
Например, •Cr , убираем из названия «хром» одну начальную букву и получаем «ром»
Разгадайте новое слово,которое можно получить, если от начала или конца названия химического элемента убрать число букв, соответствующее числу точек.
Источник статьи: http://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no8-azyk-himii-znaki-himiceskih-elementov-otnositelnaa-atomnaa-massa
Как написать атомную массу
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Размеры и массы молекул очень малы. Но размеры и массы атомов ещё меньше. Например, масса самого лёгкого атома — атома водорода равна 1,67375 • 10 -24 г, масса атома кислорода — 2,656812 • 10 -23 г, а масса атома углерода — 1,9927 • 10 -23 г. В результате производить расчёты с такими числами неудобно. Поэтому для измерения атомов и молекул была введена атомная единица массы (а.е.м.)
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
1 а. е. м. = 1,99265 • 10 -23 г : 12 = 1,66054 • 10 -24 г
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».