Гидроксид аммония

Получение гидроксида аммония
Гидроксид аммония представляет собой водный раствор аммиака. Раствор прозрачный, с резким и едким запахом. Промышленным способом и в больших количествах получение гидроксида аммония возможно растворением в воде продуктов сжигания каменного угля.
Применение гидроксида аммония
Как пищевая добавка гидроксид аммония имеет обозначение Е527 и разрешен на территории России и Украины. Его добавляют в конфеты из карамели, какао-продукты и некоторые виды шоколада. В этих продуктахгидроксид аммония поддерживает необходимое по рецептуре значение кислотности, играя роль буфера. Дело в том, что какао-бобы содержат до 2% кислот в своем составе, которые при добавлении гидроксида аммония в состав продукта нейтрализуются.
Кроме пищевой промышленности, растворы гидроксида аммония широко используются в медицине, в домашнем обиходе. 10% раствор этого вещества более известен как нашатырный спирт или аммиачная вода. При вдыхании его происходит стимуляция дыхательного центра, что применяют при потере сознания, обмороках и когда необходимо вызвать рвоту. Наружно благодаря своим антисептическим и охлаждающим свойствам гидроксид аммония подходит для обработки рук, царапин и ссадин, укусов насекомых.

Вред гидроксида аммония
Гидроксид аммония добавляется в пищевые продукты согласно технологическим инструкциям и рекомендациям, часто в комбинации с другими гидроксидами. Норма содержания этого вещества в шоколаде и какао не должна превышать 70 г/кг сухого вещества.
В ряде стран (Новая Зеландия, Австралия, некоторые европейские страны) гидроксид аммония запрещен в качестве пищевой добавки. Имеются сведения, по которым это вещество способно негативно отражаться на здоровье человека, вызывая токсические поражения печени и кишечника.
Вред гидроксида аммония заключается в том, что это довольно нестабильное вещество легко превращается в аммиак и воду. Аммиак раздражающе действует на слизистую оболочку пищеварительного тракта. Четких норм суточного потребления гидроксида аммония не разработано.
Источник статьи: http://www.neboleem.net/gidroksid-ammonija.php
Гидроксид аммония как пишется
гидроксид аммония — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN ammonium hydroxide … Справочник технического переводчика
Тетраметиловый гидроксид аммония — Общие Систематическое наименование Тетраметиловый гидроксид аммония Со … Википедия
Гидроксид магния — Гидроксид магния … Википедия
Гидроксид хрома(III) — Гидроксид хрома (III) сложное неорганическое вещество с химической формулой Cr(OH)3. Описание Гидроксид хрома (III) амфотерный гидроксид. Серо зеленого цвета, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrO(OH). Не… … Википедия
Гидроксид платины(II) — Общие Систематическое наименование Гидроксид платины(II) Традиционные названия Гидроокись платины Химическая формула Pt(OH)2 Физические свойства … Википедия
Гидроксид хрома(II) — Общие Систематическое наименование Гидроксид хрома(II) Традиционные названия гидроокись хрома Химическая формула Сr(OH)2 Физические свойства … Википедия
Гидроксид натрия — Гидроксид натрия … Википедия
Гидроксид алюминия — Гидроксид алюминия, вещество с формулой (а также … Википедия
Гидроксид кадмия — Общие Химическая формула Cd(OH)2 Физические свойства Молярная масса 146.43 г/моль Плотность 4.79 г/см³ … Википедия
Гидроксид бериллия — Общие Систематическое наименование Гидроксид бериллия Химическая формула Be(OH)2 Эмпирическая формула Be(OH)2 Физические свойства Состояние … Википедия
Источник статьи: http://dic.academic.ru/dic.nsf/ruwiki/2353
Формула гидроксида аммония
Определение гидроксида аммония и его формула
Гидроксид аммония (аммиачная вода, гидрат аммиака) представляет собой химическое соединение, принадлежащее классу оснований и образованное взаимодействием аммиака с водой.
Формула — \(\ NH_<4>OH \) или \(\ NH_<3>OH \cdot H_<2>O \)
Молярная масса составляет 35.046 г / моль.
Физические свойства — бесцветная жидкость с сильным запахом.
Гидроксид аммония — слабое основание, константа диссоциации \(\ K_=1,8\cdot 10^-5 \)
Диссоциация протекает в соответствии с уравнением:
\(\ N H_<3>+H_ <2>O \leftrightarrows N H_<4>^<+>+O H^ <->\)
Химические свойства гидроксида аммония
Гидроксид аммония является термически нестабильным, и когда раствор кипятят, выделяется аммиак:
Относительно реакционноспособный, обладает понижающими свойствами. Вступает в обменные реакции:
\(\ NH_<4>OH=HNO_ <3>\rightarrow NH_<4>NO_<3>+H_<2>O \)
Качественная реакция на гидрат аммиака представляет собой образование коричневого осадка с \(\ 4NH_<4>OH=2K_<2>H_
Основой метода получения гидроксида аммония является реакция газообразного аммиака и воды:
\(\ NH_<3>+H_<2>O\leftrightarrows NH_<3>\cdot H_<2>O\leftrightarrows NH_<4>OH \) заявка
Растворенные растворы аммиака 10% \(\ NH_ <3>\) называются аммиаком и используются в медицине, концентрированные растворы 25% \(\ NH_ <3>\) представляют собой аммиачную воду. В пищевой промышленности он зарегистрирован как пищевая добавка E527. В сельском хозяйстве используется как удобрение. Вода аммиака используется для производства аммониевых солей (азотных удобрений), в производстве соды, красителей.
Примеры решения проблем
Рассчитать рН раствора аммиака с массовой долей 30% и плотностью 0,882 г / мл.
Напишите выражение для вычисления молярной концентрации раствора:
где \(\ C_
Нужно подставить плотность раствора в g / l в формулу, но поскольку в ссылках приведены данные в г / мл, мы умножаем выражение на 1000:
Замените числовые значения в полученной формуле:
Теперь напишем уравнение диссоциации \(\ NH_<4>OH \)
Пусть х представляет собой концентрацию гидроксида аммония, которая диссоциирует, то равновесные концентрации ионов аммония и ионного гидроксида будут равны х, т.е.
Запишем выражение для константы диссоциации:
Численное значение \(\ K_
Поскольку \(\ K_
Найти концентрацию ионов гидроксида:
Рассчитайте \(\ \rho OH \) решение:
Вычислить \(\ \rho H \) раствор:
\(\ \rho H=14-\rho OH=14-1,934=12,07 \)
\(\ \rho H \) раствора аммиака составляет 12,07
Какова массовая доля гидроксида аммония в растворе, которая образуется при растворении 1 кубического метра \(\ NH_ <3>\) в 2 литрах воды в стандартных условиях.
Стандартными условиями являются Т = 298 К и Р = 1 атм = 101325 Па.
Вычислим число \(\ NH_ <3>\) в 1 кубе в данных условиях с использованием уравнения состояния идеального газа (при данных Т и Р газ можно считать идеальным):
\(\ P\cdot V=n\cdot R\cdot T \)
R — универсальная газовая постоянная, \(\ R=8,314 Дж/моль \cdot K \)
Экспресс и вычислить из этого выражения количество моля аммиака:
Рассчитайте массу \(\ NH_ <3>\) :
Теперь мы находим массу \(\ H_<2>O \) :
Нам дано, что \(\ \rho (H_<2>O)=1мл \); \(\ V=2л=2000 мл \)
Тогда \(\ m(H_<2>O)=\rho \cdot V=1 \cdot 2000=2000г \)
Найдите массу решения:
Рассчитайте массовую долю гидроксида аммония:
Массовая доля гидроксида аммония составляет 25,8%.
Источник статьи: http://sciterm.ru/spravochnik/formula-gidroksida-ammoniya/
Гидроксид аммония
Общие сведения о гидроксида аммония
Аммиак очень хорошо растворяется в воде (при 20 o С один объем воды растворяет около 700 объемов NH3). Хорошая растворимость объясняется образованием водородной связи между молекулами аммиака и воды. Поскольку молекула NH3 – лучший акцептор протона, чем H2O, то в растворе имеет место ионизация:
Появление ионов OH — создает щелочную среду раствора. Но, как это видно из значения константы основности
реакция протекает в незначительной степени. В растворе с молярной концентрацией аммиака 1 моль/л ионизируется, например, всего лишь 0,4% молекул NH3 и H2O.
При взаимодействии ионов NH4 + иOH — вновь образуются молекулы NH3 и H2O, между которыми имеет место водородная связь. Следовательно, ионное соединение NH4OH(гидроксид аммония) не существует, как не существуют гидроксид оксония OH3OH и дигидронитрид аммония NH4NH2.
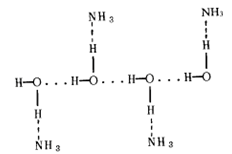
Из водных растворов аммиака выделяются два кристаллогидрата NH3×H2O и 2NH3×H2O, устойчивые лишь при низкой температуре. Молекулы аммиака и воды связаны в кристаллогидратах водородной связью. Так, NH3×H2O имеет структуру, в которой основой являются цепи из молекул воды, объединенных водородными связями. Цепи объединяются между собой в трехмерную решетку молекулами аммиака также посредством водородных связей:
Примеры решения задач
| Задание | Каковы масса и объем аммиака, которые потребуются для получения 5т нитрата аммония? |
| Решение | Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты: |
Масса нитрата аммония, рассчитанная по уравнению будет равна:
Тогда, масса аммиака, рассчитанная по уравнению:
Составим пропорцию и найдем истинную массу аммиака:
x = 17 × 5 / 80 = 1,06, значит
Найдем объем аммиака:
17 т NH3 – 22,4×10 3 м 3 NH3.
х = 22,4×10 3 × 1,06 /17 = 1,4×10 3 , значит