Натрий уксуснокислый
Химическая формула: CH3COONa*3H2O
Международное название: SODIUM ACETATE
CAS No: 6131-90-4 (Trihydrate)
Квалификация: Имп. «ч», ГОСТ 199-78
Внешний вид: бесцветные кристаллы, в массе белого цвета
Фасовка: мешки, 25 кг
Условия хранения: в сухом, хорошо проветриваемом помещении
Синонимы: Натрий ацетат, Натрий ацетат 3 водный, тригидрат натриевой соли уксусной кислоты
Мы предлагаем Натрий уксуснокислый, натрий ацетат по выгодным ценам с доставкой по всей России.
| Спецификация | |
|---|---|
| Молекулярный вес | 136.08 |
| Молекулярная масса (в а.е.м.) | 136,08 |
| Температура плавления (°C) | 58 |
| Температура разложения (°C) | 120 |
| Плотность | 1,45 (20°C, г/см3) |
| PH (5% р-р при 25 °C) | 7.5-9.0 (по факту 8.15) |
| Основного вещества | 99,0-101,0 % (по факт. 99,18 %) |
| Тяжелые металлы (как Pb), не более | 0.001 % (по факт. 0,0003 %) |
| Нерастворимые в воде вещества, не более | 0.03 % |
| Щелочи (как Na2CO3), не более | 0.05% (по факту менее) |
| Потери при высушивании (120°C) | 36-41 % (по факт. 40,54 %) |
Для согласования условий оплаты, звоните нашим менеджерам по телефонам в Москве:
(495) 787-01-37, 36, 38
(495) 787-43-51
и Санкт- Петербурге:
(812) 309-38-06 (многоканальный)
Натрий уксуснокислый 3-водный или Натрий ацетат тригидрат представляет собой тригидрат натриевой соли уксусной кислоты, выпускается в виде чешуек или кусков неправильной формы. Натрий ацетат 3 водный — растворим в воде, выветривается в сухом и расплывается во влажном воздухе. Натрий уксуснокислый при нагревании до 400 °С образует ацетон, с N2O4 -(CH3COO)2O и нитрат натрия NaNO3, с гидроксидом натрия NaOH при 200°С — СН4 и карбонат натрия Na2CO3.
Также в наличии Натрий уксуснокислый безводный.
Получение
Получают Натрий уксуснокислый 3-водный взаимодействием NaOH или Na2CO3 с уксусной кислотой или ее эфирами. Можно получить Натрий ацетат при сухой перегонке древесины с Na2CO3 и др.
Применение
Натрий ацетат 3 водный или Натрий уксуснокислый применяется:
• в медицине,
• в строительстве,
• в производстве красителей, мыл, уксусного ангидрида, ацетилхлорида, винилацетата, ацетатов меди и др.,
• как протрава при крашении тканей и дублении кож;
• как катализатор поликонденсации;
• как компонент кислых закрепителей в фотографии буферного раствора электролитов в гальванотехнике и др.
Новые поступления по выгодным ценам
В нашем ассортименте новые поступления на склад по выгодной цене:
борная кислота,
нтф кислота,
цинк хлористый,
салициловая кислота и др.
Для покупки этой и другой химической продукции и пищевых добавок в Москве или Санкт-Петербурге, звоните нам!
- Выгодные цены Даже при изначально низких ценах, мы предоставляем значительные скидки в зависимости от объема закупаемой продукции
- Быстрая отгрузка Четкая работа нашего склада позволяет осуществить быструю отгрузку необходимой продукции
- Высокое качество Работая напрямую с производителями по всему миру, мы обеспечиваем наших клиентов продукцией высокого качества
- Доставка по России Ускоренная доставка продукции:
- автотранспортом;
- железнодорожными контейнерами, вагонами;
- авиатранспортом;
- через транспортные компании.
Для получения подробной информации о ценах на химреактивы
и согласования условий оплаты звоните по телефонам:
в Москве:
+7 (495) 787-01-37
+7 (495) 787-43-51
в Санкт- Петербурге:
+7 (812) 309-38-06
Источник статьи: http://mcd-chemicals.ru/chemicals/descr70/
ацетат натрия
Cловарь химических синонимов I . Под редакцией С. Собецкой, В. Хоинского и П. Майорек . 2013 .
Смотреть что такое «ацетат натрия» в других словарях:
АЦЕТАТ НАТРИЯ — Natrii acetas. Синоним: натрий уксуснокислый. Свойства. Белый, кристаллический порошок, со слабым запахом уксусной кислоты, гигроскопичен. Хорошо растворим в воде. Форма выпуска. Препарат выпускают в форме порошка, расфасованного в полиэтиленовы … Отечественные ветеринарные препараты
Ацетат натрия — Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей … Википедия
Ацетат алюминия — Общие Систематическое наименование Ацетат алюминия Традиционные названия Уксуснокислый алюминий Химическая формула Al(CH3COO)3 Физические свойства … Википедия
Ацетат марганца(II) — Общие Систематическое наименование Ацетат марганца(II) Традиционные названия Уксуснокислый марганец Химическая формула Mn(CH3COO)2 Физические свойства … Википедия
Ацетат меди(II) — Общие … Википедия
Ацетат кобальта — Общие Систематическое наименование ацетат кобальта (II) Традиционные названия ацетат кобальта … Википедия
Ацетат меди(I) — Общие Систематическое наименование Ацетат меди (I) Химическая формула СН3СООCu Физические свойства Состояние (ст. усл.) бесцветные кристаллы … Википедия
Натрия гидроксид — Гидроксид натрия [править] Наименование едкий натр, каустик, каустическая сода, едкая щелочь Химическая формула Na OH Молярная масса 39.9971 г/моль … Википедия
Ацетат свинца(II) — У этого термина существуют и другие значения, см. Ацетат свинца. Ацетат свинца(II) … Википедия
Ацетат свинца(IV) — У этого термина существуют и другие значения, см. Ацетат свинца. Ацетат свинца(IV) … Википедия
Источник статьи: http://chemical_synonyms.academic.ru/349/%D0%B0%D1%86%D0%B5%D1%82%D0%B0%D1%82_%D0%BD%D0%B0%D1%82%D1%80%D0%B8%D1%8F
Ацетат натрия
| Ацетат натрия | |
|---|---|
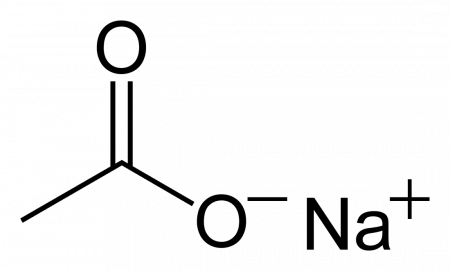 | |
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат натрий уксуснокислый |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES | |
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Токсичность | ирритант, малотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad ) или химических обогревателей (англ. Hand warmer ), применяется как составная часть смеси «горячего льда» (англ. «hot ice» ), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
- В лабораторных условиях ацетат натрия образуется при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
CH3COOH + NaHCO3 ⟶ CH3COONa + H2O + CO2↑
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 г гидрокарбоната натрия реагируют с 750 г 8%-го винного уксуса (или же с 86 г 70%-й уксусной эссенции) с образованием 82 г ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия. Для получения тригидрата ацетата натрия без выпаривания необходимо смешать 84 г гидрокарбоната натрия (пищевой соды) с 86 г 70%-ной уксусной кислоты и 10 г воды.
- Также ацетат натрия может быть получен и в ходе экзотермической реакции растворения металлического натрия в уксусной кислоте:
2CH3COOH + 2Na ⟶ 2CH3COONa + H2↑ + Q
Характерные реакции
Ацетат натрия может быть использован для образования сложного эфира по реакции с алкилгалогенидами, такими как, например, бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
2CH3COONa → Na2CO3 + (CH3)2CO 
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.
Источник статьи: http://chem.ru/acetat-natrija.html



